

Les non métaux. Un article de Wikipédia, l'encyclopédie libre.
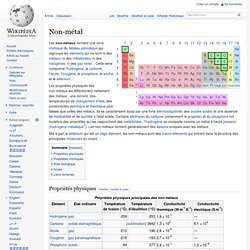
Les non-métaux forment une série chimique du tableau périodique qui regroupe les éléments qui ne sont ni des métaux, ni des métalloïdes, ni des halogènes, ni des gaz rares[1]. Cette série comprend l'hydrogène, le carbone, l'azote, l'oxygène, le phosphore, le soufre et le sélénium. Les propriétés physiques des non-métaux les différencient nettement des métaux : une densité, des températures de changement d'état, des conductivités électrique et thermique plus faibles que celles des métaux.
Ils se caractérisent aussi par une forte électronégativité, des oxydes acides et une absence de malléabilité et de ductilité à l'état solide. Certains allotropes du carbone (notamment le graphite) et du phosphore ont toutefois des propriétés qui les rapprochent des métalloïdes ; l'hydrogène se comporte comme un métal à haute pression (hydrogène métallique[2]). Propriétés physiques[modifier | modifier le code] Propriétés chimiques[modifier | modifier le code]
Hydrogène. Carbone. Un article de Wikipédia, l'encyclopédie libre.
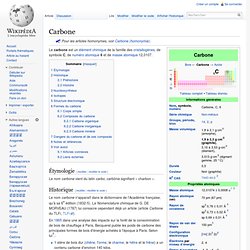
Le carbone est un élément chimique de la famille des cristallogènes, de symbole C, de numéro atomique 6 et de masse atomique 12,0107. Étymologie[modifier | modifier le code] Le nom carbone vient du latin carbo, carbōnis signifiant « charbon ». Historique[modifier | modifier le code] Le nom carbone n'apparaît dans le dictionnaire de l'Académie française, qu'à sa 6e édition (1832-5). En 1865 dans une analyse des impacts sur la forêt de la consommation de bois de chauffage à Paris, Becquerel publie les poids de carbone des principales formes de bois d'énergie achetés à l'époque à Paris. Azote. Un article de Wikipédia, l'encyclopédie libre.
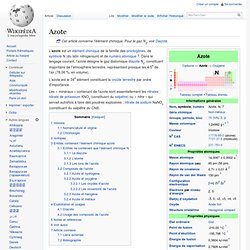
Cet article concerne l'élément chimique. Pour le gaz N2, voir Diazote. L'azote est un élément chimique de la famille des pnictogènes, de symbole N (du latin nitrogenium) et de numéro atomique 7. Dans le langage courant, l'azote désigne le gaz diatomique diazote N2, constituant majoritaire de l'atmosphère terrestre, représentant presque les 4/5e de l'air (78,06 %, en volume). L'azote est le 34e élément constituant la croûte terrestre par ordre d'importance. Les « minéraux » contenant de l'azote sont essentiellement les nitrates : nitrate de potassium KNO3 (constituant du salpêtre) ou « nitre » qui servait autrefois à faire des poudres explosives ; nitrate de sodium NaNO3 (constituant du salpêtre du Chili).
Histoire[modifier | modifier le code] Nomenclature et origine[modifier | modifier le code] Oxygène. Un article de Wikipédia, l'encyclopédie libre.
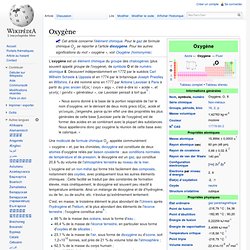
L’oxygène est un élément chimique du groupe des chalcogènes (plus souvent appelé groupe de l'oxygène), de symbole O et de numéro atomique 8. Découvert indépendamment en 1772 par le suédois Carl Wilhelm Scheele à Uppsala et en 1774 par le britannique Joseph Priestley en Wiltshire, il a été nommé ainsi en 1777 par Antoine Lavoisier à Paris à partir du grec ancien ὀξύς / oxys « aigu », c'est-à-dire ici « acide », et γενής / genês « générateur », car Lavoisier pensait à tort que[5] : Phosphore. Un article de Wikipédia, l'encyclopédie libre.
Le phosphore est un élément chimique de la famille des pnictogènes, de symbole P et de numéro atomique 15. Le phosphore se présente sous plusieurs formes de couleurs différentes : blanc-jaune, rouge et violet-noir. Très pur, le phosphore « blanc » est transparent ; plus généralement il est blanc ambré, légèrement malléable avec une faible odeur d'ail. Soufre. Un article de Wikipédia, l'encyclopédie libre. Le soufre est un élément chimique de la famille des chalcogènes, de symbole S et de numéro atomique 16. C'est un élément essentiel pour tous les êtres vivants ; il intervient dans la formule de deux acides aminés naturels, la cystéine et la méthionine et, par conséquent, dans de nombreuses protéines. Le soufre sert à 90 % à préparer l'acide sulfurique, produit de base de l'industrie chimique. Il est notamment employé comme engrais (sulfates) (60 % de la production) et phytosanitaire fongicide (contre l'oïdium de la vigne).
Environ 34 % sert à des applications non agricoles comme la fabrication du caprolactame-monomère qui intervient dans la préparation du Nylon-6, dans les processus de lixiviation en exploitation minière, à l'élaboration du dioxyde de titane, des tripolyphosphates pour les détergents, à l'alimentation animale et humaine, à la fabrication de la pâte à papier, à la fabrication de l'acide fluorhydrique. Le soufre dans la nature. Sélénium. Un article de Wikipédia, l'encyclopédie libre.
Pour les articles homonymes, voir Selenium. Le sélénium est un élément chimique, de la famille des chalcogènes, de symbole Se et de numéro atomique 34. C'est un oligoélément, mais à très faible dose. Il est toxique (voire très toxique sous certaines formes) à des concentrations à peine plus élevées que celles qui en font un oligoélément indispensable. Histoire[modifier | modifier le code]