

Métal alcalino-terreux. Un article de Wikipédia, l'encyclopédie libre.
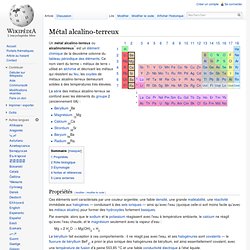
La série des métaux alcalino-terreux se confond avec les éléments du groupe 2 (anciennement IIA) : Propriétés[modifier | modifier le code] Par exemple, alors que le sodium et le potassium réagissent avec l'eau à température ambiante, le calcium ne réagit qu'avec l'eau chaude, et le magnésium seulement avec la vapeur d'eau : Mg + 2 H2O → Mg(OH)2 + H2 Le béryllium fait exception à ces comportements : il ne réagit pas avec l'eau, et ses halogénures sont covalents — le fluorure de béryllium BeF2, a priori le plus ionique des halogénures de béryllium, est ainsi essentiellement covalent, avec une température de fusion d'à peine 553,85 °C et une faible conductivité électrique à l'état liquide.
Les éléments de cette série possèdent deux électrons dans leur couche de valence, et leur configuration électronique la plus stable s'obtient par la perte de ces deux électrons pour former un cation doublement chargé. Béryllium. Un article de Wikipédia, l'encyclopédie libre.
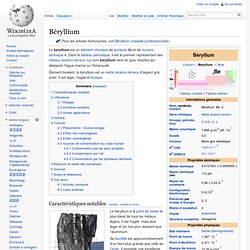
Le béryllium est un élément chimique de symbole Be et de numéro atomique 4. Dans le tableau périodique, il est le premier représentant des métaux alcalino-terreux. Le nom béryllium vient du grec beryllos qui désignait l'aigue-marine ou l'émeraude. Élément bivalent, le béryllium est un métal alcalino-terreux d'aspect gris acier. Il est léger, fragile et toxique. Magnésium. Un article de Wikipédia, l'encyclopédie libre.
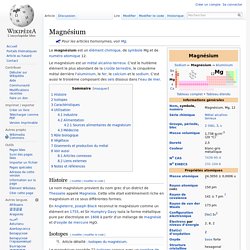
Pour les articles homonymes, voir Mg. Calcium. Un article de Wikipédia, l'encyclopédie libre.
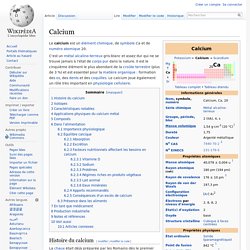
Calcium protégé sous atmosphère d'argon. Le calcium est un élément chimique, de symbole Ca et de numéro atomique 20. Histoire du calcium[modifier | modifier le code] Isotopes[modifier | modifier le code] Le calcium possède 24 isotopes connus de nombre de masse variant entre 34 et 57, mais aucun isomère nucléaire connu. Caractéristiques notables[modifier | modifier le code] Il brûle avec une flamme jaune-rouge ; exposé à l'air sec il forme une couche protectrice blanche d'oxyde et de nitrure. Strontium. Un article de Wikipédia, l'encyclopédie libre.
Le strontium est un élément chimique, de symbole Sr et de numéro atomique 38. Le strontium, comme le calcium, est un alcalino-terreux. Il est mou, malléable, gris-jaune. Baryum. Un article de Wikipédia, l'encyclopédie libre.
Le baryum (du grec barys, lourd) est un élément chimique de symbole Ba et de numéro atomique 56. L'oxyde de baryum a été découvert en 1774 par Carl Wilhelm Scheele dans des minerais de dioxyde de manganèse. Isolé en 1808 par l'Anglais Sir Humphry Davy, puis purifié par Guntz en 1901. Caractéristiques[modifier | modifier le code] Withérite (ou carbonate de baryum, toxique) C'est un métal alcalino-terreux mou argenté qui fond à 850 °C. Son protoxyde BaO est appelé baryta ou baryte anhydre. Utilisations[modifier | modifier le code] BaSO4 + SiO2 → BaSiO3 + SO3 (très haute température) BaCO3 + SiO2 → BaSiO3 + CO2 Ba(NO3)2 + SiO2 → BaSiO3 + N2O5 BaO + SiO2 → BaSiO3, Radium. Un article de Wikipédia, l'encyclopédie libre.
Le radium (dont le nom est forgé à partir du latin radius -rayon- en même temps que radioactivité) est un élément chimique de symbole Ra et de numéro atomique 88. Il est d'un aspect parfaitement blanc mais il noircit lors de son exposition à l'air libre. Le radium est un métal alcalino-terreux que l'on peut trouver en très faible quantité dans les minerais d'uranium. Il est extrêmement radioactif, la demi-vie de son isotope le plus stable (226Ra) étant 1602 ans. Il fournit du radon comme produit de désintégration.
Il est découvert par Marie Curie et son mari Pierre en 1898 par extraction de la pechblende, un minerai d'uranium. Caractéristiques physiques[modifier | modifier le code] C'est le plus dense des métaux alcalinoterreux avec lesquels ils partage des caractéristiques (comportement assez proche de ceux du béryllium, magnésium, calcium, strontium et baryum) expliquant sa cinétique environnementale ou son métabolisme. Aiguilles au radium.