

Métal alcalin. Un article de Wikipédia, l'encyclopédie libre.
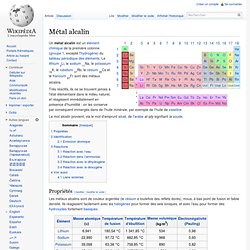
Un métal alcalin est un élément chimique de la première colonne (groupe 1, excepté l'hydrogène) du tableau périodique des éléments. Le lithium 3Li, le sodium 11Na, le potassium 19K, le rubidium 37Rb, le césium 55Cs et le francium 87Fr sont des métaux alcalins. Très réactifs, ils ne se trouvent jamais à l'état élémentaire dans le milieu naturel, et réagissent immédiatement en présence d'humidité ; on les conserve par conséquent immergés dans de l'huile minérale, par exemple de l'huile de vaseline.
Le mot alcalin provient, via le mot d'emprunt alcali, de l'arabe al-qily signifiant la soude. Propriétés[modifier | modifier le code] Leur configuration électronique est caractérisée par la présence d'un électron unique ns1, facilement perdu pour retrouver la configuration du gaz noble de la période précédente : les métaux alcalins forment donc très facilement des cations. Identification[modifier | modifier le code] Métal alcalin + eau. Lithium. Un article de Wikipédia, l'encyclopédie libre.
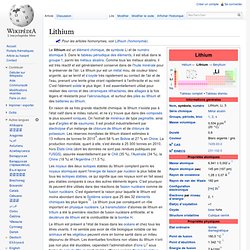
Le lithium est un élément chimique, de symbole Li et de numéro atomique 3. Dans le tableau périodique des éléments, il est situé dans le groupe 1, parmi les métaux alcalins. Comme tous les métaux alcalins, il est très réactif et est généralement conservé dans de l'huile minérale pour le préserver de l'air. Le lithium pur est un métal mou, de couleur blanc argenté, qui se ternit et s'oxyde très rapidement au contact de l'air et de l'eau, prenant une teinte grise virant rapidement à l'anthracite et au noir. C'est l'élément solide le plus léger. En raison de sa très grande réactivité chimique, le lithium n'existe pas à l'état natif dans le milieu naturel, et ne s'y trouve que dans des composés le plus souvent ioniques.
Le lithium est présent à l'état de traces dans les océans et chez tous les êtres vivants. Sodium. Un article de Wikipédia, l'encyclopédie libre.
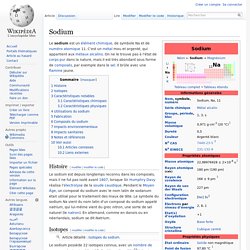
Histoire[modifier | modifier le code] Le sodium est depuis longtemps reconnu dans les composés, mais il ne fut pas isolé avant 1807, lorsque Sir Humphry Davy réalisa l'électrolyse de la soude caustique. Pendant le Moyen Âge, un composé du sodium avec le nom latin de sodanum était utilisé pour le traitement des maux de tête. Le symbole du sodium Na vient du nom latin d'un composé du sodium appelé natrium, qui lui-même vient du grec nitron, une sorte de sel naturel (le natron). En allemand, comme en danois ou en néerlandais, sodium se dit Natrium. Isotopes[modifier | modifier le code] Le sodium possède 22 isotopes connus, avec un nombre de masse variant entre 18 et 37. Caractéristiques notables[modifier | modifier le code] Caractéristiques chimiques[modifier | modifier le code] Potassium. Un article de Wikipédia, l'encyclopédie libre.
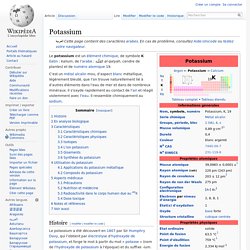
Le potassium est un élément chimique, de symbole K (latin : kalium, de l’arabe : القَلْيَة al-qalyah, cendre de plantes) et de numéro atomique 19. C’est un métal alcalin mou, d’aspect blanc métallique, légèrement bleuté, que l’on trouve naturellement lié à d’autres éléments dans l’eau de mer et dans de nombreux minéraux. Il s’oxyde rapidement au contact de l’air et réagit violemment avec l’eau. Il ressemble chimiquement au sodium. Rubidium. Un article de Wikipédia, l'encyclopédie libre.
Comme les autres métaux alcalins, il s'enflamme spontanément au contact avec l'air et réagit violemment avec l'eau. Rubidium/Métal en ampoule de verre. Production[modifier | modifier le code] On le trouve sous forme de traces (Rb2O, RbCl) dans des minerais :[réf. souhaitée] la carnallite : KMgCl3.6H2Oun sulfate multiple : KAlSi2Al2S4O10la triphyline : LiFe+2PO4 On en trouve également dans les eaux minérales (6.10-5) et l'eau de mer (2.10-5). Césium. Un article de Wikipédia, l'encyclopédie libre.
Pour les articles homonymes, voir Cs. Le césium ou cæsium[8] est l'élément chimique de symbole Cs et de numéro atomique 55. Ses propriétés chimiques sont semblables à celles du rubidium et du potassium, qui appartiennent à la même série chimique. Il est extrêmement réactif et pyrophorique, et réagit avec l'eau même à une température aussi basse que -116 °C. On extrait le césium à partir de la pollucite, tandis que ses radioisotopes sont issus des déchets nucléaires, notamment le césium 137. Francium.