

Couche électronique. Un article de Wikipédia, l'encyclopédie libre.
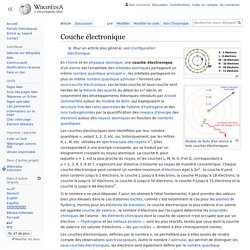
En chimie et en physique atomique, une couche électronique d'un atome est l'ensemble des orbitales atomiques partageant un même nombre quantique principal n ; les orbitales partageant en plus un même nombre quantique azimutal ℓ forment une sous-couche électronique. Les termes couche et sous-couche sont hérités de la théorie des quanta du début du XXe siècle, et notamment des développements théoriques introduits par Arnold Sommerfeld autour du modèle de Bohr, qui expliquaient la structure fine des raies spectrales de l'atome d'hydrogène et des ions hydrogénoïdes par la quantification des niveaux d'énergie des électrons autour des noyaux atomiques en fonction de nombres quantiques. Les couches électroniques sont identifiées par leur nombre quantique n, valant 1, 2, 3, etc. ou, historiquement, par les lettres K, L, M, etc. utilisées en spectroscopie des rayons X[1]. Notes[modifier | modifier le code] Références[modifier | modifier le code]
L'électron dans tous ses états. Bohr. Le modèle atomique de Bohr. I.

ThéorieLa composition d'un atome, la répartition des charges négatives autour d'un noyau positif ont été découverts aux horizons de 1912. Ce n'est qu'en 1932 que Rutherford assisté de Chadwick mettra en évidence la présence de particules neutres de masse comparable à celle d'un proton au sein du noyau.Un défi de taille reste encore à expliquer à cette époque: l'émission de lumière par des atomes. Or, à cette époque, il est connu que l'émission de photons (de lumière) correspond à une énergie. Autrement dit, si l'atome émet de la lumière, c'est qu'il perd de l'énergie ! Or, les électrons ne semblent pas s'écraser sur le noyau ou les atomes subitement disparaitre et devenir instables ! II. 1. 2. 3. 3.1 Baguettes en boisPréparer les solutions de sels métalliques en introduisant dans chaque flacon l'équivalent de 2 cuillères à café de poudre.
Schéma :blanc = sels d'antimoine(Sb) ou poudre d'aluminium (Al) 4. III. Il existe 7 couches électroniques autour du noyau d’un atome. LES ELEMENTS CHIMIQUES. Pour commencer...
Ce site rassemble les informations relatives aux 103 premiers éléments chimiques ainsi qu'à leur classification périodique, classification proposée par Dimitri I. Mendeleïev en 1869. La classification périodique est le moyen d'agencer et de classer les éléments chimiques dans un tableau à double entrée qui s'avère être d'une simplicité remarquable pour organiser l'ensemble de ces éléments en fonction de leur numéro atomique, de leurs propriétés physico-chimiques ainsi que de leur configuration électronique. Ce site est subdivisé en quatre sections distinctes Toutes les propriétés sont regroupées dans 6 catégories Généralités : les informations générales, les informations liées à leur découverte...
Configuration requise Ce site propose un certains nombre d’illustrations, de tableaux et d’éléments multimédia interactifs s’appuyant sur les dernières technologies web disponibles. Bonne visite La classification périodique. Atomes et molécules. Un atome fait environ 0,0000000001 mètre, c'est dix millions de fois plus petit qu'un millimètre !
Tiens, et qu'est-ce qu'on peut voir lorsqu'on zoome sur un atome ? Très bonne question ! Nous allons y répondre en analysant trois modèles atomiques, du plus ancien au plus récent. Un modèle, c'est quelque chose qu'on a imaginé grâce à des expériences et à l'observation de phénomènes, mais dont on n'a pas pu démontrer l'exactitude. Le modèle de Dalton Le premier modèle intéressant pour la science moderne a été imaginé par Dalton au début du XIX (= 19) ème siècle et reprenait les concepts suivants : La matière est composée de minuscules particules, appelées atomes et qui sont indivisibles (on ne peut pas les diviser, les "casser" ; ils restent entiers).Les atomes différents se distinguent par leur masse : chaque atome a une masse propre.
Pour Dalton, l'atome est donc une sphère compacte et indivisible constituant les molécules. Le modèle de Thomson Charge négative ? Eh bien rien. ). Et après ?