

Trattamenti industriai. Filtrazione. Filtrazione. Da Wikipedia, l'enciclopedia libera.

La filtrazione è un'operazione unitaria di separazione utilizzata sia in scala di laboratorio sia in scala industriale. In ambito industriale la filtrazione sfrutta macchine filtranti operative su vasta scala. Flocculazione. Da Wikipedia, l'enciclopedia libera.

Il processo inverso della flocculazione è detto deflocculazione o peptizzazione.[1] Il processo di flocculazione[modifica | modifica sorgente] Affinché avvenga la flocculazione è necessario innanzitutto destabilizzare le cariche dei colloidi. Ciò viene realizzato facendo uso di coagulanti (spesso si usa indifferentemente il termine flocculanti). Questi sono composti di varia origine che esplicano la loro azione in valori di intervallo di pH ben definiti. I coagulanti sono in genere degli elettroliti inorganici o polielettroliti organici.[2] Ecco alcuni esempi: Flottazione. Neutralizzazione, precipitazione. Neutralizzazione (chimica) Da Wikipedia, l'enciclopedia libera.

In chimica si intende per reazione di neutralizzazione una reazione acido-base che porta a un valore di pH neutro (7) a partire da valori più alti (basici) o più bassi (acidi). Un esempio è rappresentato dalla reazione stechiometrica tra acido cloridrico e idrossido di sodio, con produzione di acqua e cloruro di sodio: HCl + NaOH → NaCl + H2O. Precipitazione (chimica) Da Wikipedia, l'enciclopedia libera.

Il tipico aspetto bianco caseoso del precipitato di AgCl Tale separazione può avvenire a seguito di una reazione chimica o per una variazione delle condizioni fisiche della soluzione - ad esempio, la temperatura. La formazione di precipitati è alla base dei saggi a umido dell'analisi chimica qualitativa, in cui la verifica della presenza di un dato ione o gruppo funzionale viene resa evidente dalla comparsa di un precipitato a seguito del trattamento con un opportuno reagente - ad esempio, l'uso del nitrato d'argento per evidenziare la presenza di cloruri, bromuri e ioduri.
Trattamenti di ossido-riduzione. Ossidoriduzione. Da Wikipedia, l'enciclopedia libera.

Illustrazione di una reazione redox. In chimica, con il termine ossidoriduzione o redox (composto dall'inglese reduction, riduzione e oxidation, ossidazione) si descrivono tutte quelle reazioni chimiche in cui cambia il numero di ossidazione degli atomi, cioè tutte le reazioni in cui si ha uno scambio di elettroni da una specie chimica ad un'altra. Riduzione e ossidazione[modifica | modifica sorgente] Una reazione redox può essere pensata come lo svolgersi contemporaneo di due distinte "semireazioni":
Okf. Deferrizzazione e demanganizzazione. Tratamenti acque reflue. Trattamento delle acque reflue. Da Wikipedia, l'enciclopedia libera.
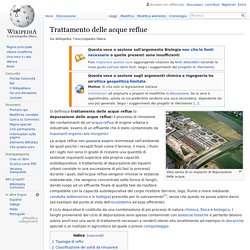
Vista aerea di un impianto di depurazione delle acque. Si definisce trattamento delle acque reflue (o depurazione delle acque reflue) il processo di rimozione dei contaminanti da un'acqua reflua di origine urbana o industriale, ovvero di un effluente che è stato contaminato da inquinanti organici e/o inorganici. Le acque reflue non possono essere reimmesse nell'ambiente tal quali poiché i recapiti finali come il terreno, il mare, i fiumi ed i laghi non sono in grado di ricevere una quantità di sostanze inquinanti superiore alla propria capacità autodepurativa.
Il ciclo depurativo è costituito da una combinazione di più processi di natura chimica, fisica e biologica. Potabilizzazione dell'acqua. Da Wikipedia, l'enciclopedia libera.

Impianto di purificazione delle acque. ferro e manganese presenti nell'acqua di origine profonda;idrogeno solforato presente nelle acque di falda o in aree vulcaniche;i solfati presenti nelle acque profonde ed in zone ad attività termale. Il secondo tipo comprende ad esempio: metalli pesanti, come antimonio, arsenico, piombo, in concentrazioni rilevabili originati dagli scarichi industriali;microinquinanti organici[2] come idrocarburi, fitofarmaci e solventi;ammoniaca, nitriti, nitrati, ecc.
Inoltre le acque grezze contengono anche forma di vita microbiologica come: La sequenza dei processi di potabilizzazione da adottare, deve essere progettata per garantire all'acqua trattata: Tuttavia il fatto che l'acqua sia per natura un solvente rende alquanto problematica l'efficace eliminazione di moltissime sostanze indesiderate. Addolcimento. Addolcimento. Da Wikipedia, l'enciclopedia libera.

Può essere considerato un caso particolare di demineralizzazione. Ciò può essere fatto per via fisico-chimica trattando il solvente (solitamente acqua) con opportuni reagenti (Ca(OH)2 e Na2CO3) o, più frequentemente, mediante l'impiego di resine a scambio ionico. Le resine a scambio ionico usate in questi casi sono resine cationiche, che funzionano tramite reazioni del tipo: CaSO4 + Rm → RmSO4 + Ca++ Se ad esempio lo ione metallico Rm è costituito da sodio Na, otterremo solfato di sodio, solubile, al posto del solfato di calcio, quasi insolubile. La rigenerazione quindi viene fatta, invece che con un acido forte, con un sale sodico di acido forte, quasi sempre NaCl, in soluzione satura, e l'eluato, nel caso illustrato, sarà costituito da CaCl2, relativamente inerte.
Disinfestazione. Disinfezione. Da Wikipedia, l'enciclopedia libera.

Disinfezione di una tuta di protezione da aggressivi chimico-biologici. Forme di disinfezione[modifica | modifica sorgente] Si usano le seguenti forme di disinfezione: Secondo l'uso si distinguono disinfettanti per oggetti, per le mani, per l'aria e per le superfici di locali. Decarbonatazione. Decarbonatazione dell'acqua. Desilicazione. Demineralizzazione. Demineralizzazione. Sedimentazione (sfrutta la legge di Stokes) Sedimentazione. Da Wikipedia, l'enciclopedia libera.

Vasche di sedimentazione rettangolari. La sedimentazione[1] in fisica è un processo per cui particelle sospese in un fluido si accumulano a causa dell'esistenza di un campo di forza. Questo può essere provocato dalla forza di gravità (sedimentazione per gravità o decantazione), dalla forza centrifuga (sedimentazione centrifuga), o dalla forza elettrica (elettrodecantazione, elettroforesi, dielettroforesi). Legge di Stokes. Da Wikipedia, l'enciclopedia libera. Forze agenti su di una sfera in un fluido: spinta idrostatica (per il principio di Archimede) Fd e la forza di gravitàFg. dove F è la forza di attrito viscoso, μ è la viscosità, r è il raggio della sfera e u è la velocità relativa tra fluido e sfera.
Degasaggio. Degasaggio. Da Wikipedia, l'enciclopedia libera. Nell'ingegneria chimica, il degasaggio è il procedimento che porta alla rimozione di gas disciolti nei liquidi (in genere acqua o soluzioni acquose). Alcune metodiche possibili per effettuare l'operazione di degasaggio sono: Degasaggio per riduzione di pressione[modifica | modifica sorgente] La solubilità dei gas nei liquidi è determinata dalla legge di Henry, secondo la quale la quantità di gas disciolto in un liquido è proporzionale alla sua pressione parziale. Quindi la riduzione della pressione comporta un abbassamento della solubilità del gas. Degasaggio per riscaldamento[modifica | modifica sorgente] Il degasaggio per riscaldamento viene condotto entro speciali apparecchiature, chiamate deareatori.
Degasaggio per sostituzione con gas inerte[modifica | modifica sorgente] Note[modifica | modifica sorgente] ^ M.