

LES ELEMENTS CHIMIQUES - Propriétés - Electronégativité (Allred) La matière - Univers-Astronomie. Qu’est-ce que la matière ?
En physique, est matière tout ce qui possède une masse c'est-à-dire qui est affectée par la gravitation. La matière occupe un certain espace et peut prendre des formes diverses selon les conditions auxquelles elle est soumise (densité, température, pression etc…). La matière, on le sait aujourd’hui, est composée de particulesComposant de la matière inférieur à la taille d'un atome. Tableau Périodique Dynamique - Property - Electronegativity. Tableau périodique des éléments. « Tableau périodique des éléments » expliqué aux enfants par Vikidia, l’encyclopédie junior Le tableau périodique des éléments regroupe tous les éléments chimiques qui constituent l'Univers : les atomes.
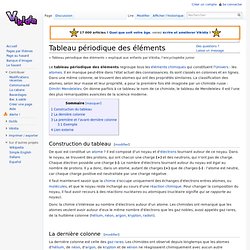
Il en manque peut-être dans l'état actuel des connaissances. Ils sont classés en colonnes et en lignes. Dans une même colonne, se trouvent des atomes qui ont des propriétés similaires. La classification des atomes, selon leur masse et leur propriété, a pour la première fois été imaginée par un chimiste russe : Dimitri Mendeleïev. Construction du tableau[modifier] De quoi est constitué un atome ? Il faut maintenant savoir que la chimie s'occupe uniquement des échanges d'électrons entres atomes, ou molécules, et que le noyau reste inchangé au cours d'une réaction chimique. Le tableau des éléments. Le tableau des éléments. Tableau périodique des éléments. Pendant l'Antiquité, on considérait les éléments différemment : les corps étaient classés en solides, liquides et vapeurs et selon leur couleur, et leur interaction suivant des notions de sympathie et d'antipathie.
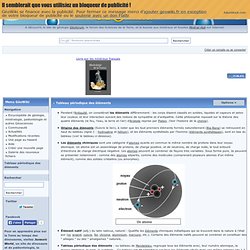
Cette philosophie reposait sur la théorie des quatre éléments (le feu, l’eau, la terre et l’air) d'Aristote reprise par Platon. (Voir l'histoire de la chimie).Origine des éléments (Suivre le lien), à noter que les tout premiers éléments formés naturellement (Big Bang) se retrouvent en haut du tableau (ligne 1 : hydrogène et hélium), et les éléments synthétisés par l'homme (éléments synthétiques), sont en bas du tableau (voir le tableau ci-dessous).Les éléments chimiques sont une catégorie d'atomes ayants en commun le même nombre de protons dans leur noyau atomique. Un atome est un assemblage de protons, de charge positive, et de neutrons, de charge nulle, le tout entouré d'électrons de charge électrique négative. Les atomes peuvent se combiner de façons très variables. L’Atome - L’Elément. C'est un système très petit (10-10 m de diamètre et 10-25 à 10-27 kg) constitué d'un noyau renfermant des protons (de charge positive égale en valeur absolue à celle de l'électron) et des neutrons de charge nulle.

Autour de ce noyau “gravitent” des électrons de charge négative. Les électrons sont situés dans des régions de l'espace proches du noyau appelées orbitales. Ces régions ne sont pas forcément sphériques et ne sont en fait que la zone de l'espace où la probabilité de rencontrer un électron est la plus grande. De manière approximative, on peut dire que les électrons sont répartis sur plusieurs couches concentriques réparties autour du noyau. LES ELEMENTS CHIMIQUES - Accueil. Pour commencer...
Ce site rassemble les informations relatives aux 103 premiers éléments chimiques ainsi qu'à leur classification périodique, classification proposée par Dimitri I. Mendeleïev en 1869. La classification périodique est le moyen d'agencer et de classer les éléments chimiques dans un tableau à double entrée qui s'avère être d'une simplicité remarquable pour organiser l'ensemble de ces éléments en fonction de leur numéro atomique, de leurs propriétés physico-chimiques ainsi que de leur configuration électronique. Ce site est subdivisé en quatre sections distinctes Toutes les propriétés sont regroupées dans 6 catégories Généralités : les informations générales, les informations liées à leur découverte...
Le seul tableau de Dimitri Ivanovitch Mendeleïev. Classification, disiez-vous?

L'observation de la diversité des êtres et des objets ne va pas, chez l'homme, sans l'envie de découvrir une organisation universelle sous-jacente. Ainsi, depuis des siècles, il aspire à une description simple de la matière qui l'environne et le compose. Dès le Ve siècle avant Jésus-Christ, Leucippe, un philosophe grec, voulait expliquer le monde par l'existence des atomes et du vide pour tenter d'échapper aux angoisses de l'au-delà et autres tourments de la superstition. Les atomes (du grec atomos, «indivisible») étaient censés être de petites unités de matière, éternelles, pleines, solides et en nombre illimité. Toujours agités de mouvements rapides, ils auraient formé, par leurs chocs mutuels, des agrégats différenciés selon leur ordre et leur position respective, comme les lettres composent des mots. C'est Johann DOBEREINER, un chimiste russe, qui a établi le premier, en 1817, un rapport entre la masse atomique des éléments et leurs propriétés.
Télécharger des documents imprimables - EniG. Tableau périodique des éléments. EniG. Tableau périodique des éléments, calculatrice et matériaux imprimable. La classification périodique de Lavoisier à Mendeleïev. Plan commenté et édité par Nicolas Lévy, responsable éditorial du site CultureSciences-Chimie à partir d'un diaporama détaillé de C.
Péan, E. Molina & F. Tableau_periodique. Comme l'arrangement des éléments dans le tableau n'est pas dû au hasard, un grand nombre de propriétés d'un élément peuvent être déduites de son emplacement dans le tableau.

Les éléments métalliques ont des propriétés communes: Eclat métallique.Conductibilité électrique et thermique.Malléabilité, ductilité.Solide à température ambiante sauf le Hg. Les éléments non-métalliques ont moins de similitudes dans leurs propriétés On divise souvent le tableau périodique en blocs*: Exercice 1: Donner les symboles pour les deux atomes suivants: a) 11 protons, 12 neutrons, 11 électrons b) 35 protons, 45 neutrons, 35 électrons Exercice 2*: Identifier la période et la famille de chaque élément ayant la configuration électronique suivante des électrons de valence: a) ns2 np3 b) ns1. CHAPITRE V I I I. 1.

Introduction Le chapitre précédent nous a donné le moyen de déterminer les orbitales susceptibles de recevoir des électrons. Il nous a montré également qu’on pouvait considérer que tous les atomes possèdent (tout au moins qualitativement) les mêmes orbitales, caractérisées par les nombres quantiques n et l. Quantitativement, les orbitales ne sont pas identiques, comme on peut le voir pour les éléments les plus simples en calculant les fonctions propres y. En d’autres termes, l’énergie de l’orbitale 4s (n = 4, l = 0) de l’atome d’hélium n’est pas égale à l’énergie de l’orbitale 4s de l’atome d’hydrogène (on peut d’ailleurs le voir directement sur le diagramme des niveaux d’énergie - chapitre 7, figure 7.1).
LES ELEMENTS CHIMIQUES - Propriétés - Exception à la règle de Klechkowski. Il existe des exceptions à la règle de remplissage des orbitales appelée règle de Klechkowski, certains métaux de transition ainsi que certains lanthanides et actinides ne respectent pas cet ordre.
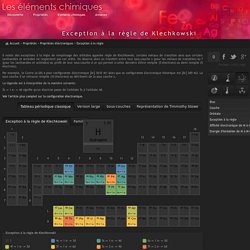
On observe alors un transfert entre leur sous-couche s (pour les métaux de transition) ou f (pour les lanthanides et actinides) au profit de leur sous-couche d ce qui permet à cette dernière d'être remplie (5 électrons) ou demi remplie (5 électrons). Par exemple, le Cuivre (z=29) a pour configuration électronique [Ar] 3d10 4s1 alors que sa configuration électronique théorique est [Ar] 3d9 4s2. La sous couche d se retrouve remplie (10 électrons) au détriment de la sous couche s. La légende est à interprétée de la manière suivante: 5s ⇒ 1 e- ⇒ 4d signifie qu'un électron passe de l'orbitale 5s à l'orbitale 4d. 3DLesTableaux. 3DLesTableaux Système du Québécium.

Version étendue du tableau périodique des éléments. Un article de Wikipédia, l'encyclopédie libre.