

Protocole pour faire croître un cristal. I - Recristallisation d'un cristal par sursaturation II - Préparation d'un cristal d'ensemencement III - Préparation de monocristaux 1 ) Obtenir une solution sursaturée 2 ) Croissance du monocristal 3 ) Croissance de monocristaux modifiés par la présence volontaire de contaminants IV - Préparation du sel de Rochelle I - Recristallisation d'un cristal par sursaturation Pour la recristallisation, on doit préparer une solution sursaturée en substance ou sel que l'on veut cristalliser.

Ainsi si on chauffe le solvant jusqu'à s'approcher de la température d'ébullition pour obtenir une solution sursaturée après refroidissement à la température de la pièce alors des cristaux peuvent très bien commencer à croître avant que la solution ait fini de refroidir. Attention, la solubilité de plusieurs sels est très sensible à la température, il faut donc contrôler la température de recristallisation le plus possible. Fiche TP. Expériences de cristallogenèses.

Remarque : Il est nécessaire de bien faire comprendre aux élèves qu'on ne crée pas des minéraux, mais des cristaux, c'est le phénomène de cristallisation qui est abordé. (Dans certains cas on utilisera même des composés issus de la chimie organique, exemple la vanilline, l'aspirine...) Ces expériences ont été réalisées dans le cadre d'un Itinéraire de Découverte SVT-Mathématiques au collège Jean Lurçat de Lanester. Elles peuvent servir de support pour un cours de géologie de 4ème ou de 1ère S, mais aussi pour les IDD et TPE. Les protocoles sont bien sur indicatifs et peuvent être modifiés par les élèves et ainsi jouer sur les paramètres de cristallisation : I - La cristallisation de la vanilline : Matériel : Vanilline de synthèse, microscopes équipés de dispositifs de polarisation de la lumière, lames, lamelles, une source de chaleur, chronomètres, thermomètres.
Protocole de base :L'observation se fait au microscope polarisant. 1. 2. 1. Fabrication de cristaux de sulfate de cuivre. Préparation de monocristaux. Vous apprendrez ici à préparer un gros monocristal à partir d'une amorce préparée précédemment. - Substance à cristalliser- Un cristal de départ ou amorce de la substance à cristalliser sur un fil de pêche- Eau distillée ou déminéralisée- Fil de pêche (1 kg) et un petit bâton de bois- Thermomètre- Balance- Récipient en plastique ou en verre de 0,5 à 1 litre- Plaque chauffante et bécher de 2 à 4 litres Optionnel - Loupe ou microscope- Bain thermostaté La masse de substance dont vous avez besoin pour votre solution (à peser sur une balance).

Noter la masse M0 utilisée.La solubilité de cette substance dans l'eau à la température de la pièce (obtenu dans un livre de référence de chimie).Il serait utile également de connaître la solubilité de cette substance à des températures légèrement supérieures. Les quantités de substance et d'eau à utiliser dépendent de la solubilité de cette substance dans l'eau à la température de la pièce et un peu plus élevées. 4. 5. 6. 7. 8. Sulfate de cuivre. Un article de Wikipédia, l'encyclopédie libre.
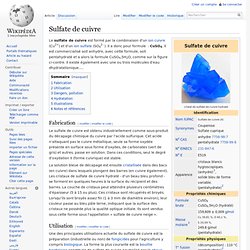
Le sulfate de cuivre est formé par la combinaison d'un ion cuivre (Cu2+) et d'un ion sulfate (SO42- ). Il a donc pour formule : CuSO4. Il est commercialisé soit anhydre, avec cette formule, soit pentahydraté et a alors la formule CuSO4,5H2O, comme sur la figure ci-contre. Il existe également avec une ou trois molécules d'eau dhydratationique..... Fabrication[modifier | modifier le code] Le sulfate de cuivre est obtenu industriellement comme sous-produit du décapage chimique du cuivre par l'acide sulfurique.
Utilisation[modifier | modifier le code] Le sulfate de cuivre était jadis appelé « vitriol bleu». Le sulfate de cuivre est aussi employé comme apport d'oligo-élément (cuivre), aussi bien en cas de carence en cuivre des végétaux, que des animaux (maladie du tour de l'œil blanc des bovins par exemple). Dangers, pollution[modifier | modifier le code] Le sulfate de cuivre est un produit toxique Hydratation[modifier | modifier le code] Sequence_Fabrication_Cristaux_EB. Fabrication de cristaux de sulfate de cuivre. Cristaux - Science amusante. Un article du site scienceamusante.net.
Cette expérience illustre le phénomène de cristallisation. Même si la (re)cristallisation est très utilisée comme méthode de purification en chimie, il s'agit plus d'un processus physique. 1 Précautions Outre les précautions en chimie qui sont d'usage, cette expérience comporte les attentions suivantes : Attention aux sels métalliques dont certains sont très toxiques voire cancérigènes et très polluants . 2 Matériel Surface de travail bien stable à l'abri des courants d'airGrands béchers en Pyrex® (1 ou 2 L)Agitateur magnétique chauffant (à défaut, une plaque chauffante)Cures-pipe (tiges métalliques recouvertes de coton)Tiges en bois pour brochettesFicelle fine en coton blancSpatules en acier inoxydable (important)Eau distillée (à défaut de l'eau déminéralisée)Produits en poudre : 3 Protocole expérimental.