

Physique_6_PROBLEME_AVEC_CORRIGE_6_B. Le noyau de est radioactif.

Sa demi-vie est t 1/2 = 5580 ans. Tous les composés carbonés participant à des échanges avec l'atmosphère ou l'eau de mer possèdent un taux de constant tant que le processus d'échange se poursuit. Cet échange qui existe pour les matériaux vivants, cesse à la mort biologique où l'assimilation de ne se fait plus. Il est alors possible de déterminer la date de la mort en mesurant le taux de désintégration de l'échantillon que l'on souhaite dater et en le comparant au taux d'un échantillon de même nature, mais vivant. La tombe de Toutankhamon, pharaon de la XVIIIème dynastie (Nouvel Empire), a été découverte inviolée dans la vallée des rois près de Louxor et un morceau de cuir trouvé dans la sépulture a été daté par cette méthode. N = No e - l . t l est la constante radioactive (en seconde) . · 1- (énoncé) Ecrivons l'équation de désintégration radioactive du noyau , radioactif b - (émission d'un électron) qui conduit à la formation d'un noyau d'azote.
Un exemple de datation au carbone 14. Cet exercice propose d'estimer l'âge d'un échantillon par la méthode de datation au carbone 14.
Cet exercice peut être abordé en terminale S dans la partie du programme de physique "Transformations nucléaires" comme dans la partie "La dimension temporelle dans l'histoire de la Terre et de la vie". Il fait appel a des notions de physique-chimie et de SVT du programme de terminale : stabilité et instabilité des noyaux, radioactivité, loi de décroissance radioactive, datation relative, datation absolue. Il fait appel aussi à des compétences mathématiques. Une fiche destinée aux élèves ainsi que la correction destinée au professeur sont proposées. Retour vers "comprendre la datation au carbone 14" Retour vers "enseigner la datation isotopique" Centre de datation par le Radiocarbone - Historique. Il y a 75 ans : la mise en évidence du carbone 14 : Le 27 février 1940, Martin Kamen et Sam Ruben à l’accélérateur de l’Université de Californie mettent en évidence l’isotope 14 C par réaction de neutrons lents sur de l’azote Cet isotope est naturellement radioactif.
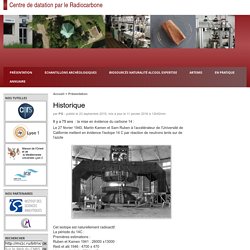
La période du 14C : Premières estimations : Ruben et Kamen 1941 : 26000 ±13000 Reid et alii 1946 : 4700 ± 470 Libby et alii 1949 : 5720 ± 47 IL y a 70ans : 1946 : la preuve de l’existence du radiocarbone naturel En 1939, S. En 1946, W.F. En 1947, E.C. En 1949, Libby, Arnold et Anderson : prouvent que l’on peut utiliser le C14 comme chronomètre Premières datations radiocarbone par Libby sur des échantillons d’ages connus. Ts_chrono_act4. Le carbone 14 est l'un des isotopes du carbone : son abondance est de 1,2 10-12 %; les deux autres isotopes sont stables, ce sont le carbone 12 et le carbone 13 présents respectivement dans la proportion de 98,89% et de 1,108%.

Schéma du cycle du 14C Une partie des neutrons créés dans l'atmosphére par les rayons cosmiques interagissent avec l'azote pour former un isotope radioactif du carbone selon la réaction: 14N(n,p) -> 14C Le carbone 14 ainsi formé s'oxyde rapidement, donne une molécule de 14CO2 qui se disperse et marque de façon uniforme par sa radioactivité le gaz carbonique atmosphérique. Ce carbone est rapidement oxydé pour donner du gaz carbonique. Le 12CO2 et le 14CO2 de l'atmosphère se mélangent et sont captés par tous les organismes vivants.
Les échanges (respiration, photosynthèse, alimentation,...) qui se passent entre l'atmosphère et le monde vivant équilibrent le rapport qualitatif de 14C et de 12C. Datation au carbone 14. Histoire de la radioactivité. L'unité structurale et chimique du vivant. I - Le monde minéral et le monde vivant II - La richesse en eau du vivant III - Les molécules du vivant IV - La cellule : l'unité structurale du vivant V - Le métabolisme : l'unité fonctionnelle du vivant VI - L'ADN : support universel de l'information génétique Résumé du cours - Source : M.Clerc. Résumé cours chapitre 2.pdf Document Adobe Acrobat 645.9 KB Une des propriétés des êtres-vivants est de fabriquer leur matière à partir des éléments disponibles dans leur milieu de vie. I- Le monde minéral et le monde vivant A/ Rappel sur la notion de molécules et d'élément chimique Les éléments chimiques sont au nombre de 92 dans l'univers connu. Cette table référence tous les éléments connus, et ceux synthétisés par l'homme (situés au bas de la table).
On définit par élément chimique une catégorie d'atomes ayant en commun le même nombre de protons dans leur noyau atomique, ce nombre, noté Z, définissant le numéro atomique de l'élément. Il existe un code couleur pour chaque atome : - Oxygène (O) : rouge. SVT2ndechapirte2composition matière vivante. La datation par le carbone 14 en vidéo. Intégrer ce média sur votre site. Datation au carbone 14.