

Estereoquímica de Diels - Alder. Detalles Categoría: Diels-Alder Escrito por Germán Fernández Visto: 15724 Diels-Alder es una reacción estereoespecífica, produce un único diastereoisómero.
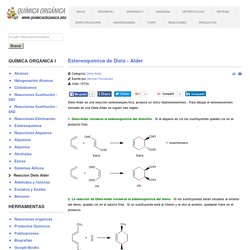
Para dibujar el estereoisómero formado en una Diels-Alder se siguen tres reglas: 1. 2. 3. El producto endo es cinético y se obtiene a temperatura moderada. En el caso de emplear dienos cíclicos se obtenen biciclos. Los cationes alilo. Detalles Categoría: Sistemas Alílicos Escrito por Germán Fernández Visto: 8461 Los carbocationes formados sobre carbonos situados en posiciones alílicas se llaman cationes alílicos.
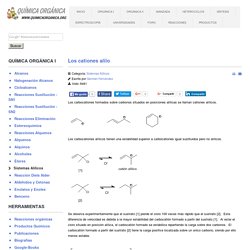
Los carbocationes alílicos tienen una estabilidad superior a carbocationes igual sustituidos pero no alílicos. Se observa experimentalmente que el sustrato [1] pierde el cloro 100 veces más rápido que el sustrato [2]. Un carbocatión alílico es tanto más estable cuantas más estructuras resonantes tenga. Ambos carbocationes poseen dos estructuras, pero en el izquiedo las cargas positivas se situan sobre carbonos primarios y terciarios, mientras que en el derecho son carbonos primarios, secundarios. Sistemas Alílicos. Nucleofilia y solvatación lección 5. La reacción SN2 será más fácil si se efectúa con un buen nucleófilo atacante.

¿Qué hace que un nucleófilo sea bueno?. A primera vista, nucleofilia y basicidad parecen estar directamente relacionadas, pero: La habilidad para ser buen grupo saliente sí se puede relacionar con la basicidad porque los dos son procesos termodinámicos. Sin embargo, la nucleofilia es un proceso cinético. Por tanto, la naturaleza del disolvente es de primordial importancia en una reacción de sustitución nucleófila. Hay dos tipos fundamentales de disolventes: Tomemos como reacción patrón el intercambio de cloro por iodo siguiente y veamos cómo varía la velocidad de reacción en función del disolvente: La reacción se produce mucho más rapidamente en DMF, disolvente que no contiene hidrógenos que pueden asociarse con el disolvente. Química organometálica con ejercicios corregidos - Didier Astruc - Google Books.
QuimOrganica12PropiedadesDelCarbono. Constitución de los compuestos orgánicos lección 1. La estructura electrónica de los átomos que constituyen una molécula orgánica determina la estructura tridimensional de ésta y sus propiedades.

Visita por ejemplo: library.thinkquest.org/3659/structures Hibridación de orbitales atómicos en el carbono Electronegatividad del carbono en función de su hibridaciónEl carbono tiene mayor electronegatividad a medida que aumenta el carácter s de la hibridación. Por tanto los carbonos del etano (sp3) son menos electronegativos que los del eteno (sp2) y éstos a su vez menos electronegativos que los del etino (sp). El cálculo de las densidades electrónicas en estos tres compuestos refleja claramente este hecho: (azul +, rojo -) Los hidrógenos tienen una coloración azul más acusada desde el etano al etino, prueba de su menor densidad electrónica como consecuencia de la electronegatividad creciente del carbono. Parámetros de enlace Consideraciones generales La fortaleza de los enlaces C-C es muy elevada.
Quimitube Tu libro de Química. Estructuras de Lewis de algunas moléculas covalentes sencillas (sin resonancia) En este ejercicio determinaremos la estructura de Lewis de algunas moléculas covalentes sencillas, es decir, que no presentan resonancia y, por tanto, sólo se pueden representar con una única estructura de Lewis.
Las moléculas son las siguientes: H2O, NH3, CO, H2S, N2, BF3, HCN, ICl3, PCl3, SF6 y BeCl2. En aquellos casos en los que se cumpla la regla del octeto en el átomo central se aplicarán las siguientes reglas: 1) Determinar el número total de electrones de valencia de todos los átomos que forman parte de la molécula (A) 2) Determinar el número total de electrones de valencia que serían necesarios para que todos los átomos tengan su última capa completa. Para el hidrógeno contaremos 2 electrones y para el resto de átomos contaremos 8 (B) 3) Determinar el número total de electrones enlazantes, restando B-A = C 4) El resto de electrones de valencia de la molécula serán no enlazantes, por lo que si a estos, A, les restamos los enlazantes, C, obtendremos los electrones no enlazantes. Presentacion septiembre 21285. TEMA3. Taller de Estereoquímica. I.- Objetivos Ver las disposiciones espaciales de los átomos de una molécula.
Construir diferentes modelos de moléculas para comprender la isomería geométrica, las conformaciones y la configuración absoluta. Construir modelos de moléculas con el fin de observarlas en tres dimensiones. II.- Información Teórica Estereoquímica La ciencia de la química orgánica, como hemos dicho, se basa en la relación entre estructura molecular y propiedades. Un aspecto de la estereoquímica es la estéreo isomería. La clase particular de isómeros que sólo se diferencian por la orientación espacial de sus átomos (pero que son iguales entre sí en cuanto a qué átomos están unidos a cuáles otros) se llaman estereoisómeros.
Clases de estereoisomería Isomería geométrica, son aquellos isómeros que se generan debido a la rigidez del doble enlace y existen dos clases: Cis (a un mismo lado) y trans (a lados opuestos). Los isómeros Cis y trans también se presentan en los compuestos cíclicos. Estereo ii. Paso de Newman a Fischer. Tema5SO.