

SALES: tipos y nomenclatura. Proyecto INFOCAB SB 202507. Algunos tipos de átomos tienden a unirse químicamente con otros átomos, iguales o diferentes, para formar moléculas y adquirir estados más estables de energía.

La unión se da a través de enlaces covalentes que dan como resultado moléculas diatómicas o poliatómicas energéticamente más estables que los átomos individuales. A la medida de dicha estabilidad se le denomina energía de enlace y es la que corresponde al cambio de entalpía necesario para romper un enlace específico de un mol de moléculas gaseosas. Cuando se forma un mol del mismo tipo de moléculas a partir de átomos gaseosos, la magnitud de la entalpía es igual, pero de signo contrario, esto es, se libera energía. Enlace químico: curvas de estabilidad energética o de Morse. Radio Atómico y Radio Iónico. TPyE.pdf. Una visión íntima de la materia. Objetivos: Conocer los componentes fundamentales del átomo.

Interpretar símbolos nucleares Interpretar la distribución energética en niveles y subniveles. Escribir configuraciones electrónicas. Interpretar los conceptos de masas atómicas y moleculares. Utilizar los conceptos anteriores en cálculo. Deducir la ubicación de elementos en la tabla periódica de acuerdo a su configuración electrónica. I.- ESTRUCTURA ATÓMICA El átomo es la partícula más pequeña de un elemento químico que mantiene su identidad a través de cambios físicos y químicos. Tabla I.1 Partículas fundamentales de la materia El átomo consiste en núcleos positivamente cargados, muy pequeños y densos, rodeados por nubes de electrones a distancias del núcleo relativamente grandes.
El núcleo atómico, debido a la presencia de los protones, está cargado con tantas cargas positivas como protones posea, y prácticamente la totalidad de la masa del átomo está contenida en él. Núcleo atómico siendo X el símbolo del elemento Ejemplo: Cómo usar la Tabla Periódica. Cuando se abre la hoja correspondiente a un elemento del Sistema Periódico, aparecen unos apartados que dan información básica del elemento.

Estos apartados son: Nombre: Procede del nombre, generalmente, latino. Los nombres de los elementos se corresponden con nombres de científicos famosos, nombres mitológicos, lugares donde se descubrieron,.... Hay problemas con los nombres de los elementos 104-109 entre la American Chemical Society (ACS) y la International Union for Pure and Applied Chemistry (IUPAC)(1). La ACS usa el nombre que hace referencia a su descubridor, mientras que la IUPAC ha decidido dejar el asunto del nombre a un grupo de 20 miembros. Radio atómico. Tabla Periodica de los Elementos. Radio Atómico y Radio Iónico. Cómo aumenta el RADIO ATÓMICO en la tabla periódica. Elementos químicos ordenados por su radio atómico. Radio atomico tabla periodica. Tabla de elementos químicos descripción [Química - Tabla de los elementos] Es lo que tienen en común la sustancia simple, sus estados alotrópicos y las sustancias compuestas.
![Tabla de elementos químicos descripción [Química - Tabla de los elementos]](http://cdn.pearltrees.com/s/pic/th/fisicanet-descripcion-106839930)
Número atómico El número atómico Z es la cantidad de protones o electrones que posee el átomo. Nombre El nombre de los elementos proviene del latín y, en general hace referencia a una característica del mismo, en otros casos se debe al nombre de la persona que lo descubrió o el lugar donde se descubrió u obtuvo. Símbolo químico Es la abreviatura que, por convención, se utiliza para representarlos, muchos símbolos químicos provienen del nombre del elemento en latín. Número másico Es la suma de los protones y neutrones presentes en el núcleo de un átomo. Grupo Los elementos de cada grupo son llamados congéneres y tienen comportamientos semejantes Período Es igual al número de órbitas o niveles de energía de un átomo, donde se encuentran distribuidos los electrones. Metales No metales Gases inertes, raros o nobles.
Tabla Periódica. Por Plinio Sosa a.

Descripción de la Tabla Periódica La Tabla Periódica de los Elementos es una representación gráfica que agrupa a los elementos según la distribución de sus electrones alrededor del núcleo. Consiste de más de 100 casillas organizadas en 4 bloques: S, P, D y F. Cada casilla corresponde a un elemento. Las columnas de los bloques S, P y D corresponden a grupos de elementos con propiedades químicas similares. En el bloque F hay otros dos grupos, en este caso en secuencia horizontal: los lantánidos y los actínidos. 3.3 Energía de ionización. La energía de ionización (EI) es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental para arrancarle el electrón más externo, que está más débilmente retenido, y convertirlo en un catión monopositivo gaseoso.
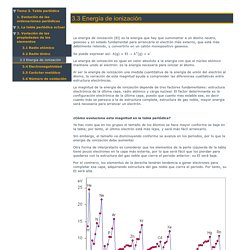
Se puede expresar así: A(g) + EI → A+(g) + e- Variación de la energía de ionización en la tabla periódica. La energía de ionización (EI) o potencial de ionización (PI) es la energía mínima necesaria para arrancar un electrón de un átomo en fase gaseosa y estado fundamental, siendo el electrón arrancado el más externo, es decir, el más alejado del núcleo.
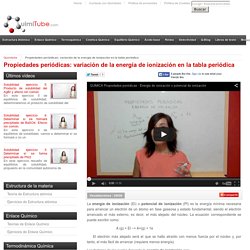
La ecuación correspondiente se puede escribir como: A (g) + EI –> A+(g) + 1e El electrón más alejado será el que se halla atraído con menos fuerza por el núcleo y, por tanto, el más fácil de arrancar (requiere menos energía). Elementos Químicos: 1ª Energía de Ionización. La energía de ionización, también llamada potencial de ionización, es la energía que hay que suministrar a un átomo neutro, gaseoso y en estado fundamental, para arrancarle el electrón más débil retenido.
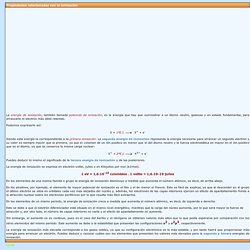
Podemos expresarlo así: X + 1ªE.I. X+ + e-