Capacité thermique massique. Un article de Wikipédia, l'encyclopédie libre.
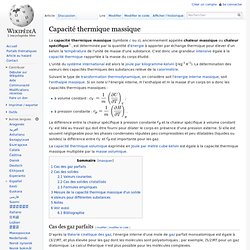
L'unité du système international est alors le joule par kilogramme-kelvin (J·kg-1·K-1). La détermination des valeurs des capacités thermiques des substances relève de la calorimétrie. Suivant le type de transformation thermodynamique, on considère soit l'énergie interne massique, soit l'enthalpie massique. Si on note U l'énergie interne, H l'enthalpie et m la masse d'un corps on a donc les capacités thermiques massiques : à volume constant : ;à pression constante : .
La différence entre la chaleur spécifique à pression constante et la chaleur spécifique à volume constant est liée au travail qui doit être fourni pour dilater le corps en présence d'une pression externe. Et est importante pour les gaz. La capacité thermique volumique exprimée en Joule par mètre cube-kelvin est égale à la capacité thermique massique multipliée par la masse volumique. Cas des gaz parfaits[modifier | modifier le code] La capacité massique à volume constant est ainsi de :
Énergie thermique. Énergie thermique. L’énergie thermique est l’énergie cinétique due aux mouvements des atomes ou molécules d’un corps.
Elle peut se mesurer en joules (unité d’énergie standard), en wattheures (unité plus communément utilisée dans la pratique industrielle) ou en électrons-volts (unité de la physique). Les échanges d’énergie thermique entre deux corps sont appelés transferts thermiques. La chaleur est un transfert thermique. La température mesure l’énergie cinétique moyenne des atomes ou des molécules et indique la capacité d’un corps à échanger de la chaleur. Quand les atomes ou les molécules sont immobiles, la température atteint un minimum absolu, qui vaut -273,15 °C (degrés Celsius). Lorsque deux corps échangent de la chaleur, leurs températures respectives évoluent et tendent à devenir égales. Académie en ligne : tous les cours de l'année en accès gratuit. Nicole.cortial.net/complements/chimie/combustions/web-combustions-ex.pdf.
Exercices. Exercice 1: Quel est le pouvoir calorifique d'un coke qui contient 90% de carbone et 10% d’un composé incombustible ?

La combustion du carbone ne produit que du CO2 ! Exercice 2 Quelle est la chaleur dégagée lors de la formation de 3 moles d'eau liquide à partir de H2 et de O2 ? Exercice 3: Un mélange gazeux a la composition suivante (en vol): 50% de dihydrogène, 10% de monoxyde de carbone, 30% de méthane et 10% de diazote. A) Quel volume d'air faut-il pour brûler 1 m3 de ce gaz et quel volume de gaz carbonique dégagera cette combustion ? B) Calculer le pouvoir calorifique de ce gaz (inf. et sup. c'est à dire en considérant respectivement la formation d'eau liquide ou gazeuse).
Exercice 4: Un gramme de benzène dégage en brûlant env. 41.9 kJ (formation de H2O liq). Exercice 5: Soit l'équation C + H2O = CO + H2. Exercice 6: On introduit dans un eudiomètre (appareil servant à l'analyse et à la synthèse des mélanges gazeux) 20 cm3 d'un mélange d'hydrogène, de méthane et d'éthylène (C2H4). Soutien scolaire gratuit Chaleur de combustion - Chaleur molaire, pouvoir calorifique et valeur energetique - REVIZ.fr. Chaleur molaire Qcomb La chaleur molaire de combustion d'un corps pur à la température T°C donnée est la chaleur de la réaction de combustion complète, sous pression constante et à cette température, d'une mole de ce corps.
L'état physique des réactifs et des produits doit être précisé. La chaleur molaire de combustion est noté Qcomb et elle est exprimée en kJ.mol-1. Pouvoir calorifique P Le pouvoir calorifique P d'un combustible ou d'un comburant est la chaleur obtenue par la combustioon complète d'un kilogramme de ce combustible ou carburant. Valeur énergétique VE d'un aliment La valeur énergétique d'un aliment est la quantité de chaleur que dégage la combustion complète d'un gramme de cet aliment.
Relations entre Qcomb, P et VE Q = m P avec Q en kJ, m en kg et P en kJ.kg-1 Q = m VE. Www.epsic.ch/phocadownload/BT/Electrotechnique/Pui_Ener.pdf. Calorimétrie: exercices. Calorimtrie.