

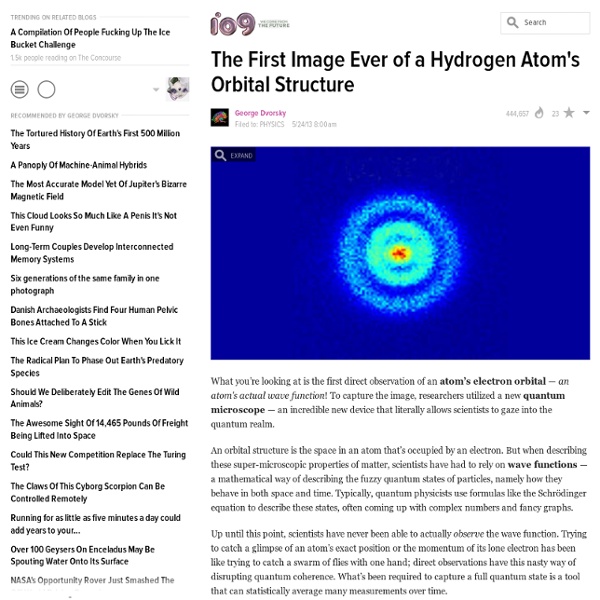
Tableau Périodique des Éléments Métaux alcalins Les métaux alcalins forment le groupe 1 du tableau périodique. Leur nom fait référence aux substances alcalines qui se forment lorsque ces éléments réagissent avec de l’eau. Le sodium et le potassium sont les éléments les plus communs. Le rubidium, le lithium et le césium sont plus rares, constituant dans l’ordre, 0,03, 0,007 et 0,0007 % de la croûte terrestre. Ces éléments sont très réactifs et se trouvent généralement dans la nature, déjà combinés avec d’autres éléments. Métaux alcalino-terreux Les métaux alcalino-terreux forment le groupe 2 du tableau périodique. Ces éléments ont un aspect gris-blanc brillant. Métaux de post-transition Les métaux de post-transition sont généralement considérés comme des éléments des groupes 13, 14 et 15. Les métaux de post-transition partagent de nombreuses similitudes avec les métaux, notamment la malléabilité, la ductilité et la conductivité de la chaleur et de l’électricité. Lanthanides Actinides Halogènes Gaz nobles Groupes Periodes
Tableau Périodique des éléments (table de Mendeleïev) Les quasi-cristaux en passe de sortir de l'oubli ? Dans les années 1980 et 1990, un nouveau type de matériaux a connu son heure de gloire en promettant une révolution dans de nombreux domaines : les quasi-cristaux, découverts par l'Israélien Dan Shechtman et ses collègues en 1982 (il obtiendra pour cela le prix Nobel de chimie en 2011). Ces solides aux propriétés inattendues, qui présentent la structure ordonnée mais pas les motifs répétitifs des cristaux ordinaires, ont en effet à l’époque émoustillé les physiciens et les industriels du monde entier. Durs comme de l’acier, avec des coefficients de frottement proches de ceux du diamant, ils présentent paradoxalement une flexibilité à haute température. S’ils entrent dans la catégorie des alliages métalliques, ils ont aussi la qualité inattendue d’être d’excellents isolants thermiques et électriques. Des microfissures comme talon d'Achille Crédits : Sophie Ramis/MM/AFP Une équipe de recherche menée par l’Université du Michigan s’est penchée sur ces parias de la physique des matériaux.
CLP : classification des produits chimiques Règlement CLP : classification des produits chimiques selon le danger Le règlement CLP, Classification Labelling Packaging a introduit de nouveaux pictogrammes, de nouvelles classes de danger et un nouveau système d’étiquettes. La législation européenne à propos de la classification, l’étiquetage et l’emballage des produits chimiques se trouve ainsi alignée sur le SGH, Système général harmonisé, proposé par les nations Unies. Ces critères harmonisés de classification et d’étiquetage devraient permettre de faciliter les échanges internationaux tout en préservant la santé humaine et l’environnement. Critères de classification du règlement CLPLe règlement CLP identifie 28 classes de danger Classification détaillée des dangers physiques des substances et des mélangesClassification des dangers sur la base des effets sur la santé Classification des produits chimiques sur la base des effets sur l’environnementCritères d’étiquetage imposés par le règlement CLP 16 classes de danger physique :
Chimie analytique niveau pharmacie, licence, master La chimie analytique est une branche de la chimie qui s'intéresse à la détermination et au dosage de composés. Elle met en oeuvre des techniques de pointe nécessitant des instrumentations coûteuses. Elle est étudiée dans l'enseignement du supérieur en pharmacie et licence. Avant de pouvoir procéder à l'analyse, plusieurs étapes sont nécessaires. La préparation de l'échantillon et sa purification sont des points essentiels. Plusieurs méthodes d'extraction sont disponibles selon la nature du composés et de sa matrice. Les analyses peuvent être qualitative (caractérisation) ou quantitative (dosage). Parmi les méthodes de chimie analytique, on peut citer : la chromatographie : outil indispensable pour la séparation et l'identification des composés d'un mélange. Le principe d'autres techniques fréquemment employées pour les dosages seront également exposées :
Chimie organique On entend par chimie organique la chimie du carbone. Ce cours s'articule autour de différents grands thèmes: - la nomenclature des composés organiques: alcanes, alcènes, cétones, aldéhydes, acides carboxyliques, éthers ester, amine, amides... - les mécanismes réactionnels : retrouvez les principaux mécanismes et la réactivité des différents groupement fonctionnels. - la stéréochimie des composés organiques: énantiomères, diastéréoisomères, configurations... La chimie des polymères est également abordée. Ce dossier comprend également un ensemble de fiches sur les techniques de manipulation au laboratoire: - méthodologie du traitement des liquide: distillation simple, fractionnée, sous pression réduite, détermination du point d'ébullition, indice de réfraction, détermination de la densité, réfraction moléculaire, le matériel de distillation Configuration électronique du carbone 6Cà l'état fondamental: 1s² - 2s² - 2p².
Systèmes cristallins et réseaux de Bravais Les cristaux sont classés en sept systèmes suivant la symétrie de leur faces, définie par des axes de symétrie autour desquelles le cristal peut tourner en présentant toujours le même aspect. Ces sept systèmes sont les suivants: cubique, hexagonal, tetragonal, trigonal, orthorhombique, monoclinique et triclinique. Un réseau de Bravais est un ensemble infini de points discrets avec un arrangement et une orientation qui apparaît exactement la même lorsqu’il est vu d’un point quelconque. Le physicien et minéralogiste français Auguste Bravais (1811-1863) définit, en 1848, à partir des différentes combinaisons des éléments de symétrie cristalline, 32 classes de symétrie, qui elles-mêmes se répartissent en 14 types de réseaux. Système cristallin cubique Axes cristallographiques Modèle 3D Dans le système cubique (ou isométrique), les trois axes cristallographiques (a, b, c) sont de longueur égale et les angles qu'ils forment sont tous égaux à 90 degrés. a = b = c α = β = γ = 90° primitif (cP)
Naming of elements of atomic numbers greater than 100 It is a generally accepted convention that the discoverer of an element has the honour of naming it. The inspiration often comes from origin, mythical characters, place, physical or chemical properties, and more recently to commemorate the names of eminent scientists. Of course, the suggestion has to be ratified by the International Union of Pure and Applied Chemistry (IUPAC). Newly discovered or undiscovered superheavy elements are often referred to in the scientific literature but until they have received permanent names and symbols from IUPAC, temporary designators are required. In 1978 IUPAC Commission on the Nomenclature of Inorganic Chemistry decided that it is necessary to have a systematic naming for the elements with atomic number greater than 100 (Z > 100), even for those which had not been discovered. Here are a few examples of the names generated for elements with atomic numbers 101 to 900. Bibliography:
History of the Periodic table of elements - EniG. Periodic Table of the Elements Faculty of Chemistry and Technology in Split The periodic table of elements is familiar to anyone that ever entered a laboratory or classroom. It has no rival in its ability to systematize and rationalize known chemical facts, predict new elements, or suggest fertile areas for further studies. This ingenious and highly functional arrangement of chemical elements was developed by several European scientists in the 19th century. What follows is a brief history of the creation of the periodic table of elements. The old Greek philosophers Tales (624-546), Anaximander (610-546), and Heraclites (540-480) claimed that all matter was made up of one fundamental principle - or element. It took almost 2000 years for someone to seriously attack Aristotle's theory of the four elements and the somewhat more contemporary three alchemical principles (mercury, sulphur, and salt). After Lavoisier the systematic approach and new experimental techniques soon led to the discovery of many new elements. I.