Exercices : équations chimiques
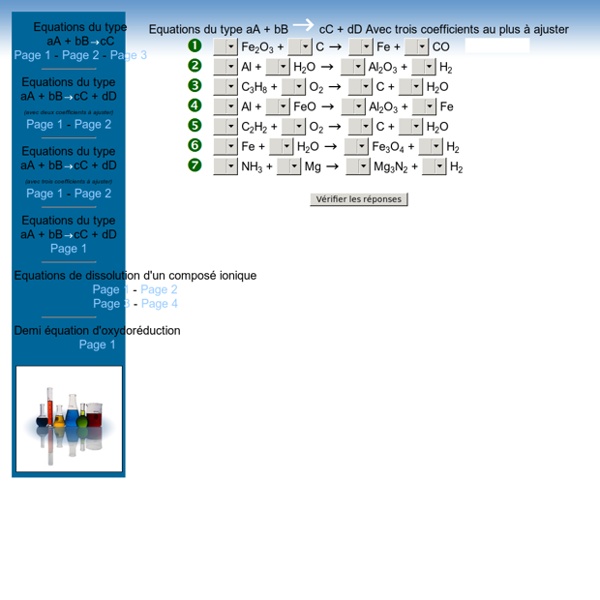
Equations du type aA + bB cC Page 1 - Page 2 - Page 3 Equations du type aA + bB cC + dD (avec deux coefficients à ajuster) Page 1 - Page 2 Equations du type aA + bB cC + dD (avec trois coefficients à ajuster) Page 1 - Page 2 cC + dD Page 1 Equations de dissolution d'un composé ionique Page 1 - Page 2 Page 3 - Page 4 Demi équation d'oxydoréductionPage 1 Equations du type aA + bB cC + dD Avec trois coefficients au plus à ajuster
The Experiments - iyc
The Global Experiment consists of four experiments. It is expected that most teachers will work with their classes to carry out the four activities, which have explicit instructions and background materials. These will be helpful for teachers who do not have science backgrounds. The activities cover important topics and conceptual understanding in science and also provide a variety of opportunities to learn important experimental and data gathering skills. Alternatively, teachers can select to undertake a single activity if they want their students to collect some data and contribute to the Global Experiment without using the other activities, perhaps because water is studied at a different year level.
Le jus de chou rouge, indicateur coloré
YannVerchier Enseignant de physicochimie De nombreuses substances naturelles possèdent la propriété de changer de couleur en fonction de l’acidité du milieu. Le chou rouge possède des colorants naturels. © Bpmm, Flickr CC by-nc-sa 2.0 Le jus du chou rouge, un indicateur coloré naturel La couleur du chou rouge est due à la présence de molécules de la famille des anthocyanes, colorants naturels présents dans de nombreux fruits rouges (fraises, mûres, cerises, myrtilles…). Préparation de l’indicateur coloré Mettre à chauffer 1 litre d’eau (une eau minérale dont le pH est neutre) dans une casserole.Couper la moitié d’un chou rouge en plusieurs morceaux et les mettre dans l’eau. Le jus de chou rouge, obtenu après filtration, est un indicateur coloré. © Dunod Le filtrat ainsi obtenu est un indicateur coloré. Les anthocyanes présents dans le chou rouge sont solubles dans l’eau et sont donc extraits par décoction.
Music, Videos & More : They Might Be Giants
Full Album This full length album was recorded over nine months in New York City with producer Patrick Dillett. Join Us is a truly remarkable album: spanning inspired electronic excursions to blazing rockers spotlighting their legendary barn-storming band. From the opening chime of “Can’t Keep Johnny Down” to the climactic blast of “You Don’t Like Me,” this is TMBG at their finest. The vinyl edition of the album is a colorful gatefold sleeve. Both CD and vinyl editions include complete lyrics. Can’t Keep Johnny Down, You Probably Get That A Lot, Old Pine Box, Canajoharie, Cloisonné, Let Your Hair Hang Down, Celebration, In Fact, When Will You Die, Protagonist, Judy Is Your Viet Nam, Never Knew Love, The Lady and the Tiger, Spoiler Alert, Dog Walker, 2082, Three Might Be Duende, You Don’t Like Me MP3, FLAC and vinyl direct from TMBG Download from iTunesMP3, CD, and vinyl from AmazonBuy local from a nearby record store Album Raises New And Troubling Questions New rarities album! Track List No!
Related:
Related:



Très bonne ressource, mais difficile pour nos élèves non ? by a_caillard Mar 12