


Biographie > Galilée, Physicien et astronome Physicien et astronome - Fondateur de la physique moderne Galileo Galilei naît à Pise en 1564. Son père, théoricien de la musique, souhaite ardemment qu'il devienne médecin, profession bien rémunérée. Ainsi, à dix-sept ans, le jeune Galilée débute des études de médecine, qu'il abandonne aussitôt : Ostillo Ricci, son professeur de dessin, parvient à le passionner pour les mathématiques, terme sous lequel on regroupait alors plusieurs de nos disciplines actuelles, notamment l'astronomie et la physique. Excessivement doué, ses biographes racontent qu'en 1583, donc à dix-neuf ans, Galilée aurait découvert l'isochronisme des pendules simplement en observant les oscillations du lustre d'une cathédrale. En 1587, il rencontre le célèbre professeur du Collège Romain, le plus prestigieux établissement d'enseignement de l'époque, le père jésuite Christopher Clavius. Galilée instruisant Vincenzo Viviani - Cette peinture que nous devons à Tito Lessi représente Galilée instruisant Vincenzo Viviani.
[Ressource] Henri Becquerel a suivi une démarche scientifique. - E.I.S.T. au collège les garrigues La démarche scientifique d’Henri Becquerel qui lui a permit de découvrir la radioactivité naturelle. Une vidéo en ligne proposée par le CEA. Bien avant que l’on parle de la démarche scientifique, des hommes ont fait preuve de curiosité et d’ingéniosité. Cet article est intéressant pour le cours Qu’est-ce que la démarche d’investigation en E.I.S.T. ?. Il permet de terminer la séance sur la présentation de la démarche scientifique que nous utiliserons souvent en E.I.S.T.. Ils ont apprivoisé le feu, utilisé des plantes pour soulager les douleurs et guérir des maladies, avec plus ou moins de succès. Ils se sont transmis leurs savoirs, d’un pays à l’autre, et d’une génération à l’autre et ont fait ainsi progresser notre connaissance. Ils étaient philosophes scientifiques ou inventeurs. Le 25 février 1896, Henri Becquerel, enveloppe une plaque photographique de papier noir épais. Puis, il dépose dessus des sels d’uranium phosphorescents, entre lesquels il met une pièce d’argent. Bien pour nous
Cours 2e Histoire : Les Hommes de la Renaissance 1 DIAPORAMA EN LIGNE LES HOMMES DE LA RENAISSANCE : Introduction : La Renaissance est une époque où l’individu place l’homme au centre de la connaissance et non plus Dieu. « L’homme de la Renaissance » se définit ainsi lui-même comme étant en rupture avec la civilisation médiévale. Les artistes et penseurs de la Renaissance sont tournés à la fois vers le passé de l’Antiquité pris comme modèle et vers le futur car ils espèrent dans le progrès humain. La Renaissance est donc une époque de bouleversement nombreux dans tous les domaines. Problématique : 1) Comment les hommes de la Renaissance ont-ils profondément bouleversé la vie intellectuelle, artistique et religieuse de leur époque ? 2) Comment la redécouverte de l’Antiquité et la soif de connaître et de comprendre conduisent-elles à une nouvelle vision de l’homme au XVI siècle ? I. Carte à remplir : Question 1 page 185 : Comparez les foyers de l’humanisme et de la Renaissance.
Un soleil, neuf planètes : Le procès de Galilée Résumé En 1543, l'astronome polonais Nicolas Copernic remet en cause le modèle géocentrique de l'univers, défendu par l'Eglise. Mais il meurt avant d'avoir réussi à prouver l'exactitude du système héliocentrique. Un siècle plus tard, Galilée reprend ses recherches et prouve que la Terre n'est pas le centre de l'univers. Il est convoqué par le tribunal de l'Inquisition en 1633... Si vous rencontrez des problèmes pour visionner la vidéo, cliquez ici Cursus - 3e / Physique - Niveau B1-B2 (Lycée) / Français langue seconde - FLE - 5e / Physique - 4e / Physique - 5e / Histoire des sciences - 4e / Histoire des sciences Enseignement transversal - Sciences physiques et chimiques / Culture scientifique et technique
La démarche d'investigation LA DEMARCHE D’INVESTIGATION en plusieurs phases : motivation « d’où part-on? » ; problématisation « qu’est-ce qu’on cherche? 1 - La motivation peut être déclenchée par : un bilan des connaissances acquises antérieurement un bilan des idées « reçues », « préconçues », « initiales » une référence à l’actualité la présentation « brutale » d’un fait un travail de bibliographie et/ou de documentation une situation concrète qui fait question : un motif, une raison, un prétexte pour chercher 2 - La problématisation peut consister à énoncer : un problème à résoudre ; un phénomène dont on cherche à comprendre le mécanisme ; un inconnu que l’on veut explorer ; une opinion dont on veut faire un savoir. 3 - La définition de la stratégie de recherche c’est préciser : 4 - La mise en œuvre de la stratégie phase dont la durée est la plus importante ; variété considérable de mises en œuvre possibles ; priorité au concret. 5 - La confrontation 6 - La terminaison
Biographie de Galilée - inventeur de la lunette astronomique Galilée est un des principaux fondateurs de notre astronomie moderne. C'est lui qui le premier, bien avant Albert Einstein, a énoncé les principes de base de la Relativité. Il est également le père de l'observation astronomique, pour avoir inventé la lunette astronomique, véritable révolution dans notre perception du ciel et notre vision du monde : Il découvre les taches solaires, les phases de Vénus, le relief de la lune, les satellites de Jupiter, les anneaux de Saturne ... Il est également un grand théoricien et fervant défenseur de la théorie héliocentrique, qu'il devra malheureusement abjurer à l'occasion de sa condamnation par le tribunal inquisiteur, au nom de la Sainte Eglise Catholique. Parcourez notre gamme de posters sur Galilée : Fils d’un musicien et compositeur florentin, Galilée naît le 15 Février 1564 à Pise. Galilée ébauche les théories de Newton et d'Einstein En 1588, il obtient grâce à l’aide de Guidolbado del Monte la chaire de mathématiques de Pise. Les étoiles
Le climat et l'histoire des civilisations VincentBoqueho Professeur de Physique Le climat est depuis toujours une préoccupation des Hommes, pour qui il détermine les conditions de vie. Comment le climat et l'histoire des civilisations peuvent-ils être liés ? Ce dossier présente une comparaison de la carte climatique du globe avec la répartition des premières civilisations. Ce dossier est construit à partir d'extraits de l’ouvrage Les civilisations à l’épreuve du climat de Vincent Boqueho (avril 2012, Dunod).
Kidi’Science : Faire pousser du sel à la maison Je me dis souvent que j’aurai dû être enseignant. Il se trouve que j’ai choisi une vie de chercheur qui ne me donne que rarement l’opportunité de le faire, mais je saute en général sur toutes les occasions qui se présentent, de la Maternelle au Master ! Il est clair que pour moi le fait de tenir ce blog est une manière de combler ce manque, et d’essayer de transmettre à d’autres mes passions, et le savoir que j’ai eu la chance de recevoir. J’ai toujours pensé que l’éveil aux sciences était quelque chose d’important, et qu’il devait se faire tôt chez les enfants, car une fois le collège venu, les sciences peuvent malheureusement devenir un repoussoir pour les élèves. C’est vrai que sur ce blog, je suis la plupart du temps bien au delà du niveau primaire (même si je m’efforce de rester autant que possible abordable avec un bagage maximum de lycée.) Aujourd’hui, nous allons découvrir comment on fabrique du sel ! Faire pousser du sel : une expérience à faire à la maison (dès 3 ans) Like this:
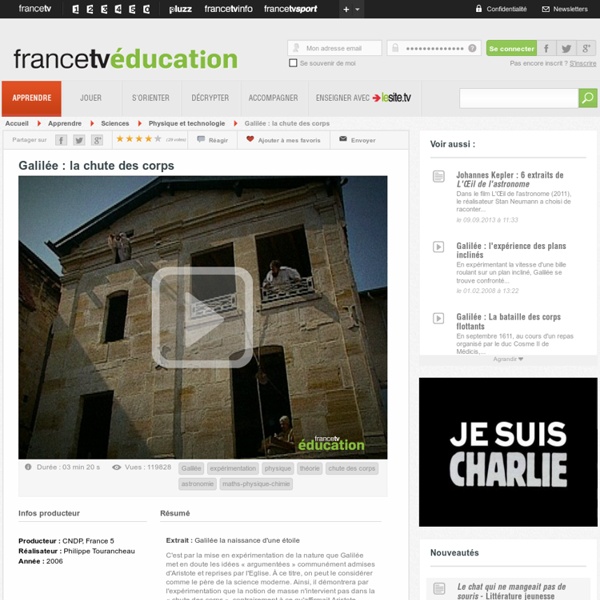
Cours Histoire 2e : L'essor d'un nouvel ordre scientifique et technique (XVI - XVIII) 2 II. Comment Galilée a-t-il fondé la conception moderne de l’univers ? Qui est Galilée ? Lien : repas avec le duc Cosme de Médicis et expérience sur les corps flottants (7min10) : Qui est le mécène de Galilée ? _ Galilée est un savant de la ville de Florence dont le mécène est le duc de Cosme de Médicis. Pourquoi Galilée est-il en désaccord avec les autres savants ? Les opposants de Galilée sent base sur un savoir hérité de l’Antiquité comme les écrits d’Aristote pour comprendre le monde. La méthode scientifique de Galilée l’exemple de la chute des corps Lien les expériences de Galilée sur de la chute des corps (3 min 20) : Quelle est la méthode de Galilée ? Galilée pratique l’observation et l’expérimentation. Quelle est la force de cette méthode ? L’expérience permet de démontrer la réalité scientifique. Que prouve Galilée ? ou
Mythologie grecque Comme le montre l’abondance des monuments, des œuvres d’art et toute la tradition littéraire qui va d’Homère aux travaux des mythographes modernes, la mythologie grecque est l’une des plus riches qui soient. Art et Littérature W. BOUGUEREAU (© Arnot Art Museum Elmira, N.Y.) Votre navigateur ne gère pas JavaScript Un examen rapide de ses informations diverses peut laisser croire que ces légendes plus ou moins merveilleuses se présentent comme un tout cohérent, qui aurait été codifié et ordonné par le temps pour être facilement compréhensible pour un esprit moderne et figé une fois pour toute. Il n’en est rien, car l’étude de la mythologie est de plus en plus féconde et aboutit à des progrès incessants et réguliers grâce aux découvertes de l’archéologie, de la linguistique ou de l’ethnologie, de même l’interprétation de ces mythes est en constante évolution. La mythologie de l'antiquité classique comporte un très grand nombre de dieux, de déesses, de demi-dieux, ou de héros.
Détecter la présence d’iode dans le sel dit « iodé » avec une patate | Rock'n'Science Vous revenez du marché avec votre sac ou boîte de sel. Le marchand vous l’a vendu comme « iodé ». L’est-il vraiment ? La carence en iode concerne encore 54 pays et près de 36% des enfants scolarisés dans le monde selon l’OMS ! Famille présentant un goitre au Mozambique Avec l’appui logistique d’une simple patate fraîche et de R’n’S, il est possible de détecter la présence d’iode dans le sel de cuisine ! Le principe : la pomme de terre contient beaucoup d’amidon, ce sera notre réactif indicateur, puisque ce polysaccharide réagit avec l’Iode en changeant de couleur : l’amidon se colore en violet. Chimie / Chimie analytique Manipulation DÉTECTION DE L’IODE DANS LE SEL IODÉ (MÉTHODE I : la patate) Observation : présence de KI ou NaI dans le sel dit "iodé" Paramètre : coloration spécifique d’un réactif-test, l’amidon de la pomme de terre, qui se colore en violet en présence d’iode Matériel : 1 récipient1 écrase-patate Réactifs : 10g de sel iodéUne demi patate fraîche (pas cuite !) Mode opératoire :