

Compacité (cristallographie) Un article de Wikipédia, l'encyclopédie libre.
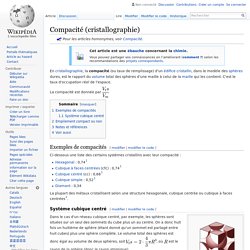
La compacité est donnée par Ci-dessous une liste des certains systèmes cristallins avec leur compacité : La plupart des métaux cristallisent selon une structure hexagonale, cubique centrée ou cubique à faces centrées[2]. Cubique à faces centrées. Un article de Wikipédia, l'encyclopédie libre.
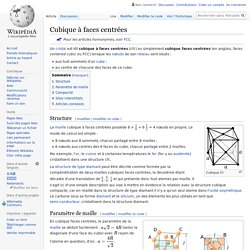
Un cristal est dit cubique à faces centrées (cfc) ou simplement cubique faces centrées (en anglais, faces centered cubic ou FCC) lorsque les nœuds de son réseau sont situés : aux huit sommets d'un cube ;au centre de chacune des faces de ce cube. Structure[modifier | modifier le code] 8 nœuds aux 8 sommets, chacun partagé entre 8 mailles ;6 nœuds aux centres des 6 faces du cube, chacun partagé entre 2 mailles.
Par exemple, l'or, le cuivre et à certaines températures le fer (fer γ ou austénite) cristallisent dans une structure cfc. Réseau de Bravais. Un article de Wikipédia, l'encyclopédie libre.
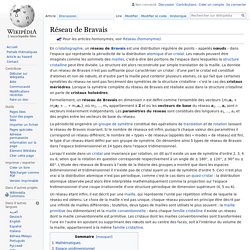
Formellement, un réseau de Bravais en dimension n est défini comme l'ensemble des vecteurs {m1a1 + m2a2 + ... + mnan}, où m1, ..., mn appartiennent à Z et où les vecteurs de base du réseau a1, ..., an sont n vecteurs linéairement indépendants. Les paramètres du réseau sont constitués des longueurs a1, ..., an et des angles entre les vecteurs de base du réseau. Lorsqu'il existe dans un cristal une invariance par rotation, on dit qu'il existe un axe de symétrie d'ordre 2, 3, 4 ou 6, selon que la rotation en question corresponde respectivement à un angle de ± 180°, ± 120°, ± 90° ou ± 60°.
L'étude des réseaux de Bravais à l'aide de la théorie des groupes a montré que dans les espaces bidimensionnel et tridimensionnel il n'existe pas de cristal ayant un axe de symétrie d'ordre 5. Structure cristalline. Réseau cristallin[modifier | modifier le code] À cause de la périodicité du réseau, toute paire de nœuds (O, M) définit un vecteur : étant des entiers relatifs.
Système cristallin. Un article de Wikipédia, l'encyclopédie libre.
Un système cristallin est un classement des cristaux sur la base de leurs caractéristiques de symétrie, sachant que la priorité donnée à certains critères plutôt qu'à d'autres aboutit à différents systèmes. Une classification plus fine regroupe les cristaux en différents systèmes. Il existe deux types de systèmes, selon que le critère de classification est la symétrie du réseau ou la symétrie morphologique. Historiquement, ces deux systèmes ont été indistinctement appelés système cristallin, ce qui a été à l'origine de la confusion dans la littérature surtout minéralogique. Maille (cristallographie) Un article de Wikipédia, l'encyclopédie libre.
Pour les articles homonymes, voir Maille. En cristallographie, une maille est une partie finie de l'espace par translation de laquelle le motif cristallin infini peut être obtenu à nouveau. Cristal. Cristaux de sel obtenus par cristallisation lente dans une saumure à température ambiante.
On appelle « phénocristal » ou « monocristal » un cristal de taille telle qu'il est visible à l’œil nu. Liaison covalente. Une liaison covalente est une liaison chimique dans laquelle deux atomes se partagent deux électrons (un électron chacun ou deux électrons venant du même atome) d'une de leurs couches externes afin de former un doublet d'électrons liant les deux atomes.
Cristallographie. Un article de Wikipédia, l'encyclopédie libre.
Elle est en rapport avec des disciplines aussi diverses que la physique, la chimie, les mathématiques, la biophysique, la biologie, la médecine, la science des matériaux, la métallurgie ainsi que les sciences de la terre. Histoire[modifier | modifier le code] Le cristal, d'abord simple objet de curiosité, passionna les collectionneurs avant d'intriguer les savants qui, en étudiant sa structure, ébauchèrent les premières théories sur la constitution intime de la matière. Graphite. Un article de Wikipédia, l'encyclopédie libre.
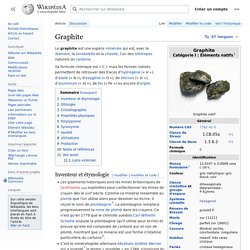
Le graphite est une espèce minérale qui est, avec le diamant, la lonsdaléite et la chaoite, l'un des allotropes naturels du carbone. Sa formule chimique est « C » mais les formes natives permettent de retrouver des traces d'hydrogène (« H »), d'azote (« N »), d'oxygène (« O »), de silicium (« Si »), d'aluminium (« Al »), de fer (« Fe ») ou encore d'argile. Inventeur et étymologie[modifier | modifier le code] À la fin du XVIIIe siècle le chimiste suédois Carl Wilhelm Scheele a démontré que la plombagine (qu'il utilisait pour écrire) ne contenait pas de plomb et que ce minerai était une forme cristalline particulière du carbone.C'est le minéralogiste allemand Abraham Gottlob Werner qui a inventé le terme « graphite » en 1789, s'inspirant du grec γράφειν (graphein = écrire).
Carbone. Le carbone est l'élément chimique de numéro atomique 6 et de symbole C. Il possède trois isotopes naturels : 12C et 13C qui sont stables ;14C qui est radioactif de demi-vie 5 730 années ce qui permet de dater des éléments utilisant du carbone pour leur structure[a]. Biréfringence. Un article de Wikipédia, l'encyclopédie libre. Le texte apparait en double après avoir traversé le cristal de calcite. Cristallographie. [modifier] Cristallographie Cristallographie du latin crystallus cristal (objet de cristal, glace, ...), dérivé du grec ancien krystallos glace ; et de graphie écriture.La cristallographie est la science qui se consacre à l'étude des substances cristallines à l'échelle atomique.
Diamant et graphite. Graphite, diamant, tout ça c'est du carbone... Alors pourquoi ces différences? Et oui, c'est ce que dit la chimie: formule du graphite: C et formule du diamant: C aussi Les différences entre ces deux frères sont spectaculaires: Mais comment expliquer toutes ces différences, alors même qu'ils sont composés d'exactement des mêmes atomes? La raison tient à la façon dont sont arrangés ces atomes les uns par rapport aux autres. Ces structures permettent déjà de comprendre la différence de dureté. Le diamant et ses utilisations dans l’industrie. Le diamant n’a pas que des vertus ornementales ! Les bijoutiers ne sont donc pas les seuls à manipuler quotidiennement la pierre éternelle. Les professionnels de l’électronique, les horlogers et les fabricants d’outils de coupe font aussi la part belle au diamant dans leurs ateliers. Le diamant dans l'industrie. Diamant. Propriétés du diamant.
Les propriétés mécaniques. PROPRIETES.