

Introduction à la chimie quantique. La règle de Walsh. Réarrangement Pinacolique. Méthode des fragments. La théorie des orbitales moléculaires est, à ce jour, la théorie la plus aboutie en matière de description de l'infiniment petit.

Elle est basée sur l'équation de Schrödinger, qui permet de relier une fonction d'onde, représentant un électron ici, à son énergie. De par sa grande complexité, il est difficile, voire impossible, de résoudre directement cette équation pour un système moléculaire donné. Nous devons donc utiliser des modèles, développés au cours du XXème siècle, pour pouvoir approcher les OM et les différentes propriétés pouvant être mise en lumière grâce à elles.
Il faut cependant garder en mémoire que ces méthodes de résolution, quelles qu'elles soient, ne restent que des approximations des solutions exactes qui ne peuvent être obtenues que par la résolution de l'équation de Schrödinger. Méthode des fragments. Effet inductif et effet mésomère. 2.Effet mésomère La mésomérie désigne le fait que des électrons peuvent se délocaliser sur une ou plusieurs liaisons d'une molécule. Dans ce contexte, sa représentation de Lewis n'est plus unique mais résulte d'une combinaison de plusieurs structures dites mésomères. Seuls les électrons de type sont concernés par cet effet, qui naît du recouvrement d'orbitales (généralement des orbitales p) avec des orbitales vacantes et/ou des doublets non liants. Une molécule présentant plusieurs formes mésomères est stabilisée.
Comparaison entre les approches de type VSEPR et les calculs de chimie quantique. Orbitales Atomiques / Orbitales Moléculaires. Exercices transverses-Prise en main des logiciels. Prise en main de Gabedit : Ouvrez le logiciel Gabedit pour arriver sur l'interface principale. La construction des différentes structures se fait par le biais de l'onglet Geometry>Draw Vous arrivez ainsi sur cette nouvelle interface : Sur le coté, vous disposez d'une barre d'outil vous permettant de créer votre molécule, soit en insérant des atomes, soit en insérant des fragments déjà pré-enregistrés dans le logiciel ( bouton insert a fragment ).
Une nouvelle interface apparaît où vous aurez le choix entre de nombreux fragments. Lorsque votre molécule est construite, fermez cette interface (la structure est automatiquement sauvegardée), puis cliquez, dans l'interface principale, sur l'icône GAMESS en dessous de l'onglet File , pour ouvrir l'interface dédiée à la création du fichier d'entrée (input) GAMESS. Les étapes de la description d'un mécanisme réactionnel. Nous allons aborder le protocole classique de la caractérisation d'une réaction chimique, tant d'un point de vue structural qu'énergétique. Généralement, les structures des réactifs et des produits -qui sont des minimums d'énergie sur la surface- sont caractérisés par un protocole d'optimisation de la géométrie.
On pourra se reporter au chapitre qui traite des protocoles de minimisation de l'énergie. On vérifie alors que les fréquences sont toutes positives. Dans certains cas, les structures ont même pu être caractérisées expérimentalement, ce qui va simplifier le protocole. On prendra soin d'utiliser le même niveau de théorie pour calculer le Hessien que pour réaliser l'optimisation de géométrie. Les méthodes de la fonctionnelle de la densité. L'idée est d'utiliser une observable physique pour déterminer l'énergie du système.
En 1964, Hohenberg et Kohn ont définit un théorème qui démontre que l'énergie d'un système, dans son état fondamental, est complètement déterminé par sa densité électronique (r). Par contre, il n'y a pas de forme analytique connue permettant de relier l'énergie à la densité électronique. Caractérisation des points stationnaires dans l'approximation harmonique. La diagonalisation de cette matrice mène à des vecteurs propres, qui sont en fait les vecteurs représentant les modes normaux de vibration de la molécule dans la géométrie considérée.

Les points caractéristiques d'une surface. Cela signifie que les systèmes moléculaires classiques, tels qu'on va les étudier, vont minimiser leur énergie potentielle en évacuant l'excès sous forme de dissipation (chaleur) ou sous la forme d'une autre énergie (l'énergie cinétique).

Par exemple, une bille posée sur le sommet d'une surface concave -initialement avec une énergie potentielle élevée et une énergie cinétique nulle- va rouler pour atteindre le point la plus bas de la surface et ainsi minimiser son énergie potentielle et acquérir de l'énergie cinétique. Il y a eu un transfert d'énergie. Cette énergie cinétique va elle-même se dissiper par frottements sur la surface et se transformer en chaleur. À l'équilibre, la bille possède une énergie potentielle minimale, le surplus ayant été évacué vers l'extérieur. Il en va de même pour les molécules. Les processus chimiques que nous étudirons mettent en jeu des réactifs et des produits qui sont des états d'équilibres.
La surface d'énergie potentielle. Vers la description de chemins réactionnels-Introduction. Les méthodes post-HF. Nous avons vu dans le chapitre précédent que, dans le cadre de la méthode Hatree-Fock, la fonction d'onde était définie par un déterminant de Slater.
Les orbitales qui sont utilisées sont des orbitales de Slater qui ont été construites de telle façon à ce que chaque électron ressente un champ moyen provenant des autres électrons. On peut donc en conclure que la méthode Hatree-Fock ne peut pas rendre compte des interactions instantanées des électrons : la méthode Hatree-Fock ne tient pas compte de la corrélation électronique. Pour augmenter la précision de nos calculs, il est donc nécessaire de corriger ou de compléter la méthode Hatree-Fock. De nombreuses méthodes existent, seules certaines d'entre elles vont être décrites ici. Les méthodes post-HF. Les méthodes Hartree-Fock et semi-empiriques. Nous avons vu dans le chapitre précédent, dans le développement de la méthode Hartree-Fock, qu'on est amené à calculer un grand nombre d'intégrale de la forme : étant donné que les intégrales J et K sont développées sur les Orbitales Atomiques du système.
Les méthodes semi-empiriques Dans le développement de la méthode Hartree-Fock présenté dans le chapitre précédent, toutes ces intégrales sont calculées, y compris celles impliquant les électrons internes. Dans les méthodes semi-empiriques, ce protocole de calcul va être simplifié en appliquant diverses approximations supplémentaires : la contribution des électrons internes sera négligé les électrons de valence seront représentés par une base minimale de Slater (voir chapitre précédent) certaines intégrales seront évaluées à l'aide de paramètres empiriques la plupart des intégrales multicentriques seront négligées.
Les méthodes Hartree-Fock restreintes (RHF et ROHF) et la méthode non-restreinte (UHF) Les différentes méthodes de chimie computationnelle-Introduction à la chimie computationnelle. Le passage de la théorie à la pratique requiert encore quelques notions.
Toutefois, les fondements théoriques dépassant les attendus de ce module, ne seront présentés que les concepts généraux des méthodes que l'on peut mettre en place lors d'un calcul de chimie quantique. Ainsi, seront rappelées ci-après les différentes familles de méthodes utilisables dans le cadre d'une étude d'un système moléculaire par Chimie quantique. Les différents thèmes qui vous sont proposés par la suite reprennent certaines de ces familles de méthodes. Chacune d'entre elle a montré sa force, mais aussi certaines de ses faiblesses, dans le cadre de ces études appliquées. Les Orbitales Moléculaires-La Méthode Hatree-Fock. Nous avions défini un Hamiltonien électronique approché : Le corrolaire de cette approximation est alors que la fonction d'onde totale peut-être considérée comme le produit des solutions mono-électroniques de cette équation On écrit :
Les Orbitales Moléculaires-Les bases d'orbitales atomiques. Les orbitales de Slater Les orbitales hydrogénoïdes sont les solutions de l'équation de Schrödinger appliquées à un système monoélectronique.

L'étude d'un système comportant plusieurs électrons mène à l'introduction d'un potentiel coulombien répulsif électron-électron dans l'écriture de l'Hamiltonien complet, ce qui entraîne de considérables complications pour sa résolution. Afin de rendre cette résolution plus aisée, on applique une approximation considérant les électrons indépendamment les un des autres. Dès lors, l'Hamiltonien complet peut s'écrire comme la somme d'Hamiltoniens mono-électroniques et ses solutions sont alors le produit des orbitales hydrogénoïdes. Ce type de solution ne tient pas compte de la répulsion électronique. Les Orbitales Moléculaires-Les bases d'orbitales atomiques.
Les Orbitales Moléculaires-Introduction : La représentation des Orbitales Atomiques et les Méthodes de résolution de l'équation de Schrödinger. Les deux premiers chapitres nous ont permis de définir la forme des équations et de leurs solutions d'un coté au niveau atomique et de l'autre au niveau moléculaire.
Nous avons pu voir que de nombreuses approximations étaient nécessaires pour obtenir une résolution aisée de l'équation de Schrödinger. Ceci va avoir un impact important sur la précision des résultats obtenus. Malgré tout, les protocoles présentés dans ces deux premiers chapitres doivent être mis en œuvre d'un point de vue calculatoire. Et dans ce cadre, quelques étapes doivent encore être dépassées. Les Orbitales Moléculaires-Introduction : La représentation des Orbitales Atomiques et les Méthodes de résolution de l'équation de Schrödinger.
L'opérateur hamiltonien-2/ Localisation d'orbitales - Orbitales localisées de BeH2. L'opérateur hamiltonien-1/ Localisation d'orbitales - Orbitales localisées du méthane. La molécule de méthane, CH 4 , possède une géométrie tétraédrique qui peut être insérée dans un cube, comme présenté dans la figure ci-dessous : L'atome de carbone occupe le centre du cube alors que les quatre atomes d'hydrogène occupent quatre des huit sommets. Ces derniers sont donc à équidistance de l'atome de carbone. Les orbitales atomiques du carbone jouant dans la construction des orbitales moléculaires sont les orbitales 2sc, 2pxc, 2pyc et 2pzc. Chaque orbitale 1s (notées 1s1, 1s2, 1s3 et 1s4) des atomes d'hydrogène seront également impliquées dans les orbitales moléculaires. L'opérateur hamiltonien-Orbitales Moléculaires d'une molécule diatomique hétéronucléaire. On suppose que les deux noyaux de deux atomes de type différents sont maintenus à une distance fixe (ce qui revient à appliquer l'approximation de Born-Oppenheimer).
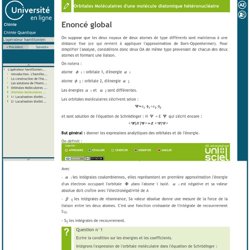
Pour simplifier l'analyse, considérons donc deux OA de même type provenant de chacun des deux atomes et formant une liaison. L'opérateur hamiltonien-Orbitales Moléculaires d'une molécule diatomique homonucléaire. L'opérateur hamiltonien-Les solutions de l'Hamiltonien moléculaire : les orbitales moléculaires. La méthode LCAO.
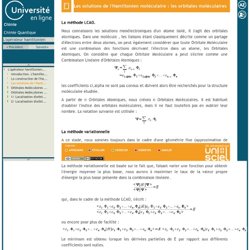
L'opérateur hamiltonien-Les solutions de l'Hamiltonien moléculaire : les orbitales moléculaires. L'opérateur hamiltonien-La construction de l'Hamiltonien moléculaire et les approximations. Un hamiltonien complet décrivant les particules d'un système moléculaire complexe (plusieurs atomes) peut s'écrire sous la forme simplifiée : avec - T e et T N les expressions décrivant le comportement cinétique des électrons et des noyaux respectivement. - V eN correspond au potentiel attractif ressenti par les électrons placés dans le champ positif des noyaux. - V NN et V ee sont respectivement les potentiels électrostatiques répulsifs noyau-noyau et électron-électron.
L'opérateur hamiltonien-Introduction. L'hamiltonien Moléculaire - La construction des orbitales moléculaires – Le cadre du modèle. Les Orbitales Atomiques-Les spin-orbitales. L'électron est une particule chargée en mouvement autour du noyau. Dans ce cadre, il a été démontré que l'électron possède un moment magnétique permanent, qui est appelé moment magnétique orbital. Le mouvement associé de l'électron est appelé mouvement orbital. Lorsque cet électron est placé dans le champ d'une impulsion magnétique, alors un terme supplémentaire décrivant cette origine magnétique doit être ajouté à l'énergie potentielle de l'électron. Les fonctions propres de l'opérateur Hamiltonien que nous avons décrit précédemment, et qui ne comporte pas de terme magnétique, sont encore fonctions propres de ce nouvel opérateur. Les Orbitales Atomiques-Nomenclature, Nature et Propriétés des solutions obtenues. Les Orbitales Atomiques-Nomenclature, Nature et Propriétés des solutions obtenues.
Les Orbitales Atomiques-L'atome hydrogénoïde. Les Orbitales Atomiques-Introduction - Les orbitales Atomiques et Moléculaires. Solutions de l'équation de Schrödinger. Avant propos – Introduction-Avant propos – Introduction. Les termes de Mécanique Quantique, Physique quantique et Chimie quantique sont des termes qui effraient souvent le lecteur. S'il est vrai que le développement des théories requiert des notions de mathématiques relativement avancées et parfois une certaine nécessité d'abstraction, il n'en demeure pas moins que les développements récents des logiciels rendent désormais accessibles une grande partie de leur domaine d'application.
En particulier, la Chimie quantique, aussi dénommée Chimie théorique ou Modélisation moléculaire, a fait l'objet de nombreux développements logiciels qui permettent à un chimiste avisé de réaliser des calculs plus ou moins compliqués et surtout d'en tirer des résultats qui lui permettront une analyse affinée du système moléculaire étudié. Toutefois, les thèmes choisis ici, restent dans le cadre d'une progression pédagogique touchant des thèmes allant de la première année universitaire jusqu'à la troisième.
A quoi sert un calcul de Chimie quantique ? Forces de London. Forces de Keesom. Page(s) en rapport avec ce sujet : Forces de Keesom. Forces de Debye. Force de van der Waals. Introduction à la chimie quantique. Spintronique. Spinorbitale. Singulet. Résonance de Feshbach. Rayon de van der Waals. Pseudo-potentiel. Matrice de Fock. Interaction de configuration. Ionisation. Interaction de configuration. Hybridation. Hamiltonien moléculaire. Fonction d'état de configuration. Erreur de superposition de base. Diagramme d'orbitales moléculaires. Déterminant de Slater. Densité électronique. AM1. Approximation de Born-Oppenheimer.
Case quantique. Champ multi-configurationnel auto-cohérent. Chimie quantique directe. Conditions d'Eckart. Configuration électronique. Configuration électronique. Corrélation électronique. Couplage vibronique. Chimie quantique. Chimie quantique. Modèles mathématiques de la chimie quantique atomique & dynamique quantique et spectre multifractal. Introduction à la chimie quantique. Éléments de chimie quantique. Méthodes mathématiques en chimie quantique. Une introduction.