

Fenomenos del mojado y no mojado. Campus.usal.es/~fises/PDF/cont_romero_enrique_jose-manuel_file1.pdf. FENOMENOLOGIA DE LA HISTERESIS DE MOJADO. Toda superficie de un líquido tiene una tensión superficial que tiende a hacer la superficie de la misma la mínima posible.

Esto es debido a que el conjunto de átomos en la superficie tiene una energía mayor que las que se encuentran en el interior. Supóngase una gota sobre la superficie de un solidó, este problema ya se ha abordado y plantea la siguiente solución: Cuando se inclina suficientemente el plano sobre el cual esta situada la gota, esta empieza a deslizarse y el ángulo de mojado (A) cambia de forma diferente según se trate de la parte delantera o trasera de la gota. A este fenómeno se le llama histéresis de mojado. Supóngase que de alguna forma se obliga a que la superficie inferior de la gota permanezca en contacto sin moverse con respecto a la superficie del solidó, al inclinar la gota se produce un desplazamiento viscoso de las laminas superiores del liquido que tienden a deformar la superficie. Fuente: Wikipedia.
Ángulo de contacto. El ángulo de humectancia se refiere al ángulo que forma la superficie de un líquido al entrar en contacto con un sólido.
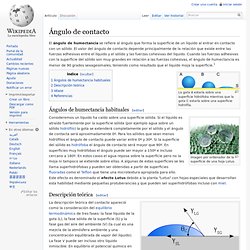
El valor del ángulo de contacto depende principalmente de la relación que existe entre las fuerzas adhesivas entre el líquido y el sólido y las fuerzas cohesivas del líquido. Cuando las fuerzas adhesivas con la superficie del sólido son muy grandes en relación a las fuerzas cohesivas, el ángulo de humectancia es menor de 90 grados sexagesimales, teniendo como resultado que el líquido moja la superficie.[1] La gota A estaría sobre una superficie hidrófoba mientras que la gota C estaría sobre una superficie hidrófila. Ángulos de humectancia habituales[editar] Imagen por ordenador de la superficie de una hoja Lotus. Consideremos un líquido ha caído sobre una superficie sólida.
Descripción teórica[editar] Ejemplo de un ángulo de humectancia en un líquido. , la energía sólido-líquido como y la energía líquido-vapor (véase tensión superficial) como donde y el más bajo (retrocedido) Definicion de Tensión Interfacial. Tensión Interfacial (σ ) Dos fluidos inmiscibles en contacto no se mezclan y los separa una interfase.

¿Porque? .Ahi veremos la tension interfacial. Porque las moléculas de estos fluidos tienen afinidad con las moléculas de su propia clase. Cerca de la superficie las moléculas se atraen con mayor intensidad produciendo una fuerza mecánica en la superficie que se conoce como tensión interfacial, σ. y esta "Tensión interfacial" es el resultado de efectos moleculares por los cuales se forma una interfase o superficie que separa estos fluidos; si σ es nula, entonces se dice que los fluidos son miscibles entre si.
La tensión interfacial juega un papel muy importante en la recuperación mejorada , ya que si este parámetro se hace despreciable, entonces se tendrá un único fluido saturando el medio, el cuál tendrá una mayor movilidad. Un ejemplo de líquidos inmiscibles son el agua y el aceite, en tanto que el agua y el alcohol si son miscibles. Pagina Principal. Mojabilidad. Gota de agua sobre una superficie ideal.
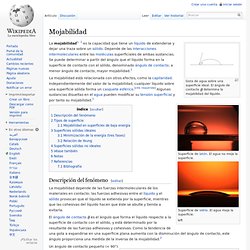
El ángulo de contacto determina la mojabilidad del líquido. La mojabilidad[n. 1] es la capacidad que tiene un líquido de extenderse y dejar una traza sobre un sólido. Fuerza intermolecular. En principio se debe distinguir qué es un Enlace Químico, siendo éstas las fuerzas que mantienen a los átomos unidos formando las moléculas.
Y que existen dos tipos de enlaces químicos, los enlaces covalentes (en donde los átomos comparten dos electrones) y las interacciones débiles no covalentes (interacciones débiles entre iones, moléculas y entre partes de las moléculas). Las interacciones débiles no covalentes se les llama "débiles" porque representan la energía que mantienen unidas a las especies supramoleculares y que son considerablemente más débiles que los enlaces covalentes.
Las interacciones no covalentes fundamentales son: El enlace de hidrógeno (antiguamente conocido como puente de hidrógeno)Las fuerzas de Van der Waals, que podemos clasificar a su vez en: Dipolo - Dipolo.Dipolo - Dipolo inducido.Fuerzas de dispersión de London. Historia[editar] Enlace de hidrógeno[editar] Los enlaces de hidrógeno se encuentran en toda la naturaleza. Fuerza de Van der Waals[editar] y Amino. Fuerzas de Van der Waals. Los lagartos gecko pueden adherirse a las paredes y techos, debido a las fuerzas de Van der Waals.
En fisicoquímica, las fuerzas de Van der Waals (o interacciones de Van der Waals), denominada así en honor al científico neerlandés Johannes Diderik van der Waals, es la fuerza atractiva o repulsiva entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas al enlace covalente o a la interacción electrostática de iones con otros o con moléculas neutras.[1] El término incluye: fuerza entre dos dipolos permanentes (fuerzas de Keesom o interacción dipolo-dipolo)fuerza entre un dipolo permanente y un dipolo inducido (fuerzas de Debye)fuerza entre dos dipolos inducidos instantáneamente (fuerzas de dispersión de London) También se usa en ocasiones como un sinónimo para la totalidad de las fuerzas intermoleculares.
Introducción a la materia[editar] Las fuerzas de Van der Waals incluyen a atracciones entre átomos, moléculas, y superficies. Véase también[editar] Iver Brevik, V.