

Validation des logiciels utilisés dans le SMQ. Nouveauté de la norme ISO 13485:2016, il faut désormais valider les systèmes informatisés utilisés dans le cadre du SMQ, une exigence que l’on retrouve : § 4.1.6 : logiciels utilisées dans le SMQ ( au sens large)§ 7.5.6 : logiciels utilisés dans le cadre de la production ou des prestations de service§ 7.6 : logiciels utilisés dans le cadre de la surveillance / mesure (du produit ou de vos activités) Cet article présente l’approche attendue pour de telles vérifications, en accord avec le guide ISO TR 80002-2. ce texte a été écrit à quatre mains, merci à Frédéric Bouchardie pour son expertise !
Première réponse : pour éviter les non-conformités. C’est une nouveauté et ce point est particulièrement suivi lors des audits ISO 13485:2016. Seconde réponse : pour éviter une catastrophe industrielle : le logiciel de contrôle final des dispositif donne des faux positifs ? Nous confions de plus en plus de responsabilités aux logiciels, ils doivent être validés en conséquence. Guide pour les porteurs de projet de dispositif médical. Vous portez un projet de dispositif médical ?
Vous voulez y voir clair dans ce monde fait de normes et de règlementations ? Vous vous questionnez sur les coûts, les durées et les ressources nécessaires pour mettre sur le marché un DM ? Ce guide est fait pour vous aider à identifier et à comprendre les exigences qui pèsent sur le secteur, il est destiné à tout porteur de projet : start-up, PME, et même personne individuelle. Bienvenue dans l’aventure du DM ! Statut des produits dans le règlement 2017/745.
Statut des produits dans le règlement 2017/745 Évaluez le statut règlementaire de vos dispositifs selon le règlement relatif aux dispositifs médicaux à propos utilisation : appliquez le questionnaire pour chaque fonctionnalité de votre dispositif, une unique revendication médicale suffit pour que le dispositif soit dispositif médical statuts possibles : dispositif médical, accessoire de DM, dispositif sans finalité médical soumis au règlement, dispositifs combinés, dispositif hors règlement.
Le questionnaire tient compte des exigences et définitions du règlement (UE) 2017/745. Qualitiso - Le Blog des Dispositifs Médicaux. Annuaire du dispositif médical ajouter une fiche Annuaire des acteurs du dispositif médical : fabricants, sous traitants, sociétés de conseil, laboratoires, autorités, ...
L'annuaire est mis à jour en continu. Utilisez les différents champs de recherche ou explorez la carte interactive. Distributeurs : obligations avec le règlement dispositifs médicaux. Qu’il soient spécialisés ou généralistes, petits ou gros, en ligne ou physiques : les distributeurs de dispositifs médicaux voient leurs obligations considérablement augmenter avec le nouveau règlement 2017/745 relatif aux dispositifs médicaux.
Tour d’horizon des exigences applicables aux distributeurs, du contrôle des produits à la gestion des actions de matériovigilance. Définition de distributeurArticle 14 : obligations générales pour les distributeurs La définition est la suivante : toute personne physique ou morale faisant partie de la chaîne d’approvisionnement, autre que le fabricant ou l’importateur, qui met un dispositif à disposition sur le marché, jusqu’au stade de sa mise en service. Règlement 2017/745 : calendrier détaillé. Retrouvez la liste des échéances prévues par le nouveau règlement relatif aux dispositifs médicaux, par ordre chronologique.
Des étapes à prendre en compte par les différents acteurs du DM : fabricants, autorité compétente et autres organismes notifiés. Lorsque disponible : un lien est donné vers les documents de la commission. Le tableau sera mis à jour … jusqu’en 2027 remarques : [✍️] Normes pour les DM. [dossier] Quand l'Intelligence Artificielle devient Dispositif Médical. Sujet d’actualité, l’intelligence artificielle excite les utilisateurs, intéresse les fabricants, donne espoir aux patients, mobilise des missions gouvernementales et fait vendre du papier.
![[dossier] Quand l'Intelligence Artificielle devient Dispositif Médical](http://cdn.pearltrees.com/s/pic/th/intelligence-artificielle-163681062)
Et c’est vrai, l’IA commence à arriver dans le médical : des start-up sont prêtes à disturber tous azimuts et les gros fabricants de dispositifs médicaux s’associent avec les gros spécialistes de l’intelligence artificielle. Cet article pour tenter d’y voir plus clair, avant d’affronter d’accompagner les changements. L’article étant très long (je me demande si quelqu’un va tout lire) voici un sommaire / résumé cliquable : 1. Comment définir l’intelligence artificielle ? 2. 3. 4. 5. 6. Liens Des articles, podcasts, vidéos et rapports sur l’intelligence artificielle. Et pour commencer sur une note légère, un résumé des prédictions de Laurent Alexandre* . * : urologue parti étudier la fiscalité en Belgique, LR est surtout connu pour ses ouvrages de SF post-apocalyptique et ses numéros de stand-up.
Règlement (UE) 2017/745 : guide de survie à destination des fabricants de dispositifs médicaux. Le règlement 2017/745 relatif aux dispositifs médicaux vient d’être publié aux JO de l’UE, il entrera en application dans 3 ans (voir le calendrier).

Le texte est conséquent, le niveau d’exigence renforcé et les nouveautés sont nombreuses. Ce bref guide doit vous aider à planifier la transition. L’article est construit sous forme de liste de points à vérifier, avec à chaque fois un renvoi vers la partie applicable du règlement et une vision rapide des actions à mettre en œuvre. Support de présentation : Règlement UE sur les DM - Medinov. Comme promis : vous retrouverez en libre téléchargement le support utilisé hier, dans le cadre de la présentation du nouveau règlement européen relatif au dispositif médicaux à Medinov.
Cliquez pour télécharger la présentation J’ai dû aller très (trop) vite lors de la présentation, le support est là approfondir le sujet. IEC 62304 - Logiciels de Dispositifs Médicaux- en bref. Vous embarquez du soft dans un dispositif médical ?
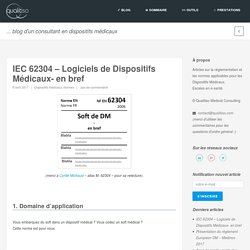
Vous codez un soft médical ? Cette norme est pour vous. Mettez en place en processus de gestion des risques selon l’ISO 14971. Système : votre soft + le soft externe + le hardware autour.Système logiciel : votre soft (embarqué dans un DM ou autonome).Élément logiciel : le savant découpage de votre logiciel en gros, moyens et petits morceaux (découpage en µ-contrôleur, librairies, fichiers sources, fonctions, …).Unité logiciel : les plus petits morceaux résultats du découpage. Apps de santé : guide des mauvaises pratiques. Alors que la France et l’Europe songent à encadrer les applications mobiles dédiées à la santé (la mHealth) je vous propose un guide des mauvaises pratiques illustré par des applis réellement proposées sur les stores. Que ce soit chez google ou apple, ces applis sont disponibles dans les catégories « médecine » et « santé / forme », ce référentiel des mauvaises pratiques se focalise sur les apps à la frontière du médical, en excluant tout ce qui est sport/régime/relaxation … Vu avec iCare : « Sans aucun dispositif extérieur, directement via le smartphone, permet de mesurer la tension artérielle, la fréquence cardiaque, la vision, l’audition, la capacité vitale du poumon, l’indice de psychologie, le daltonisme et autres données corporelles, et de fournir des programmes de santé ciblés et interactifs. »
Rôles et obligations dans le Règlement DM. Le nouveau règlement sur les dispositifs médicaux clarifie les obligations des différents acteurs de la vie d’un dispositif médical. Cet article reprend les définitions et exigences applicables aux fabricant, mandataire, importateur et distributeur. Le règlementent identifie jusqu’à 4 rôles, tous ne sont pas nécessaires en fonction des cas et un même acteur peut jouer différents rôles.
EN 60601-1-2:2015 et documents d'accompagnement. La norme 60601-1-2 est une norme collatérale de la 60601-1 (sécurité électrique), elle concerne la compatibilité électromagnétique (CEM). La version 2015 fait partie des normes harmonisées pour les dispositifs médicaux, elle sera utilisée par les laboratoires d’essais pour vérifier la CEM de votre dispositif. La 60601-1-2:2015 induit un changement : exit les tableaux de CEM qui – avouons le – étaient incompréhensibles pour les utilisateurs, exemple : ceci n’est pas un cours de math La forme est maintenant plus littéraire, les exigences sont dans le §5.2 de la norme. Cet article les présente. Règlement Dispositifs Médicaux - Les coquilles de la version FR.
Cet article fait écho à un travail engagé sur linkedin de détection des coquilles de la version française du règlement DM. Les erreurs sont remontées au conseil Européen en charge de la traduction au fil des découvertes, je vous invite à contribuer, dans les commentaires ou sur linkedin. L’article suit les chapitre du règlement. Les dernières versions des textes EN et FR sont trouvables via ce formulaire de recherche sur le site du conseil. Rq : les erreurs sont barrées, les modifs à apporter sont en gras. Séction 2 – évaluation de la conformité Article 42 – Procédures d’évaluation de la conformité Point 4 : « Les fabricants de dispositifs de classe IIb IIa autres que des dispositifs sur mesure ou des dispositifs faisant l’objet d’une investigation appliquent une procédure d’évaluation de la conformité sur la base d’un système de gestion de la qualité, conformément à l’annexe VIII … » Sans quoi les DM de classe IIa sont les grands oubliés du règlement.
III – Règles de classification. E-santé et dispositifs médicaux : les déclarations à l'ANSM. L’occasion d’observer la pénétration de la e-santé en France, côté DM. La méthode est artisanale : j’ai regardé les société connues et cherché quelques mots clés. N’hésitez pas à me suggérer des produits. Ces sociétés sont des stars de la communication, sur le net, la télé, les réseaux sociaux et les différents événements IRL. Ils sont partout, pour nous chanter leur chanson sur leur révolution. Visiomed 25 dispositifs sont déclarés : essentiellement des tensiomètres et des thermomètres. Visiomed n’est pas fabricant mais déclarant, c’est à dire qu’ils pratiquent l’OBL (Own Brand Labeling) : des dispositifs sont achetés en Asie et rebrandés Visiomed.
Le fabricant est Nexmed Technology Co Ltd. Les DM relèvent de la e-santé car ils papotent avec votre smartphone, qui sert d’IHM et de périphérique de stockage. iHealth 7 produits sont déclarés : tensiomètres, oxymètre, mesures de paramètres cardiologiques … Quel planning pour le nouveau règlement DM ? Définition de DM et portée du règlement relatif aux dispositifs médicaux. Règlement DM - quand des dispositifs Esthétiques deviennent Médicaux.
Classification des DM dans le nouveau règlement : les changements. Logiciels médicaux et nouveau règlement sur les DM. EN ISO 13485:2016 - Les principales évolutions. NF EN ISO 13485:2016 et finalités réglementaires. Lien entre l'IEC 60601-1 et la gestion des risques des DM. Mise à jour de la liste des DM communiqués à l'ANSM. L’ANSM vient de mettre à jour la liste des dispositifs médicaux qui lui ont été communiqués. Cette liste concerne les classes de dispositifs médicaux suivantes: IIa, IIb, III et DMIA (Dispositif Médical Implantable Actif). C’est la directive 93/42/CEE relative aux dispositifs médicaux qui fixe les règles: « Pour tous les dispositifs médicaux des classes IIa, IIb et III, les États membres peuvent, lors de la mise en service sur leur territoire, demander la communication de toutes les données permettant d’identifier de tels dispositifs, avec leur étiquette et leur mode d’emploi. »directive 93/42/CEE – Article 14.
Symboles pour l'étiquetage des DM (EN 15223-1 et EN 980) ISO 13485 - Liste des procédures obligatoires. Normes harmonisées à la 93/42/CEE: changements au 10/07/2015. NF EN 60601-1-11 - Dispositifs électromédicaux utilisés au domicile. Formulaire d'évaluation de la classe d'un DM. Rédiger une déclaration CE de conformité. Documents utiles aux fabricants de dispositifs médicaux. Les Directives Européennes. NF EN ISO 14971:2013 - 2nd tirage et annexes Z. Directive 93/42/CEE relative aux Dispositifs Médicaux. ISO 14971 - Le dossier de gestion des risques.
ISO 14971 - Gestion des risques des DM: introduction. Liste des dispositifs médicaux communiqués à l'ANSM. E-santé: attentes + craintes = défis. PR NF EN ISO 13485:2015 ⇒Dispositifs médicaux - SMQ à des fins réglementaires. Dispositifs médicaux: les chiffres en France - Qualitiso. Gadgétisation de la santé: Médical vs Bien-être - Qualitiso. E-santé, m-santé, DM connecté: la réglementation expliquée - Qualitiso.
Exigences essentielles pour les Dispositifs Médicaux. Marquage CE des dispositifs médicaux: Vue globale. Dispositifs médicaux: classes, types et autres groupes. Certification d'un dispositif médical électrique. Déclaration CE de conformité des dispositifs médicaux de classe I. I, IIa, IIb, III: Les classes de dispositifs médicaux. Les normes applicables aux dispositifs médicaux. Norme 60601-1: Sécurité de base et Performances essentielles des DM. Normes Harmonisées au titre de la directive 93/42/CEE. Dispositif Médical: La définition Européenne, appliquée en France.