

Laboratorio en Química 4.0 [PRÁCTICAS QUÍMICA 6] 6.1 Conductividad de Disoluciones 6.2 Electrolisis 6.3 Formulario 6.1.1 Conductividad de Disoluciones - Introducción: Para que una disolución sea conductora de la electricidad es necesario la presencia de iones en la misma.
![Laboratorio en Química 4.0 [PRÁCTICAS QUÍMICA 6]](http://cdn.pearltrees.com/s/pic/th/laboratorio-quimica-practicas-256753084)
Así, aquellas sustancias que en disolución se disocian formando iones conducen electricidad y se denominan electrolitos; por el contrario las sustancias que no conducen la electricidad cuando están disueltas se denominan no electrolitos. Los no electrolitos son sustancias que en disolución no se disocian formando iones. Los compuestos iónicos se caracterizan, entre otras cosas, por ser conductores de la electricidad cuando están disueltos o fundidos: así los iones que los forman, átomos o grupos atómicos con carga positiva ó negativa, tienen gran libertad para moverse y por eso pueden transportar la electricidad.
Siempre que una disolución es conductora de la corriente eléctrica, es porque en ella existen iones. Glucose Dilution Problem. Conservation of Mass - PhET Interactive Simulations. Reactants, Products and Leftovers - Chemical Reactions. Calculadora de masa molar - EniG. Tools. Isotopos y Masa Atómica PhET Simulation. MATERIAL DE LABORATORIO. Tabla Periodica de los Elementos. Juego de Tipos de enlace. Polaridad de los enlaces. Naturaleza del enlace químico. Enlace iónico. Partículas de los átomos e iones. Espectros de emisión y absorción. Ya sabemos que cuando hacemos pasar la luz a través de un prisma óptico se produce el efecto llamado dispersión que consiste en la separación de las distintas longitudes de onda que forman el rayo incidente.
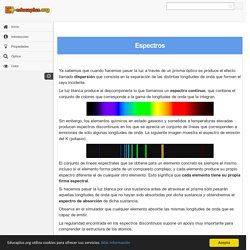
La luz blanca produce al descomponerla lo que llamamos un espectro continuo, que contiene el conjunto de colores que corresponde a la gama de longitudes de onda que la integran. Sin embargo, los elementos químicos en estado gaseoso y sometidos a temperaturas elevadas producen espectros discontinuos en los que se aprecia un conjunto de líneas que corresponden a emisiones de sólo algunas longitudes de onda. La siguiente imagen muestra el espectro de emisión del K (potasio): Modelo atómico de Bohr. Orbitales atómicos. Energía de los orbitales. Configuración electrónica. Recuerda que el número atómico de un elemento es el número de protones que hay en su núcleo.
Por ejemplo, el número atómico del magnesio es 12 es decir, que en el núcleo de un átomo de magnesio hay 12 protones. Un átomo neutro tiene el mismo número de electrones y protones. ¿Cuántos electrones hay en un átomo neutro de magnesio? Actividad 1 Selecciona el hidrógeno en la tabla. Ejercicios de configuración electrónica 1. Palabra circular elementos. Puzzle Tabla Periódica. Masa atómica. Radio atómico. Tp.htm. Memoria elementos. Alpha Widgets: "Lewis structure" - Free Chemistry Widget.