

Isomería. Alcanos. Los Alcanos son compuestos formados por Carbono e Hidrógeno que sólo contienen enlaces simples carbono–carbono.
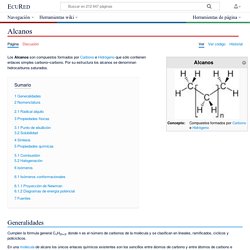
Por su estructura los alcanos se denominan hidrocarburos saturados. Generalidades Cumplen la fórmula general CnH2n+2, donde n es el número de carbonos de la molécula y se clasifican en lineales, ramificados, cíclicos y policíclicos. ¿Cómo nombrar alcanos de cadena ramificada? Nomenclatura de Alcanos -Lección Teórica. Alcanos. Detalles Categoría: Alcanos-Teoría Escrito por Germán Fernández.
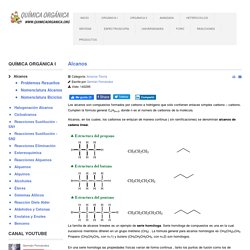
Radicales. Se denomina radicales a las porciones de moléculas que poseen una composición y estructura características.
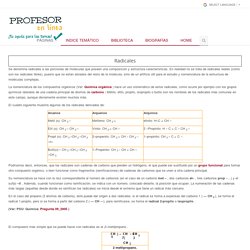
En realidad no se trata de radicales reales (como son los radicales libres), puesto que no están aislados del resto de la molécula, sino de un artificio útil para el estudio y nomenclatura de la estructura de moléculas complejas. La nomenclatura de los compuestos orgánicos (Ver: Química orgánica ) hace un uso sistemático de estos radicales, como ocurre por ejemplo con los grupos químicos laterales de una cadena principal de átomos de carbono : Metilo, etilo, propilo, isopropilo o butilo son los nombres de los radicales más comunes en este campo, aunque obviamente existen muchos más.
El cuadro siguiente muestra algunos de los radicales derivados de: Su nomenclatura se hace con la raíz correspondiente al número de carbonos (en el caso de un carbono met – , dos carbonos et– , tres carbonos prop –…) y el sufijo –il . Metil, isopropil, neopentil, terbutil, etc. Grupos funcionales. Inicio. Orbitales Moleculares Sigma,Pi e Hibridacion. ¿Qué son los hidrocarburos? Tipos y ejemplos (con imágenes) - Toda Materia. Hidrocarburos: clasificación, propiedades y características. Te explicamos qué son los hidrocarburos y cómo se clasifican.
Además, cuáles son sus características y propiedades químicas y físicas. Los hidrocarburos son un conjunto de compuestos orgánicos. Sus moléculas están compuestas por átomos de carbono e hidrógeno, organizados en diversas estructuras dependiendo del tipo de hidrocarburo. En su mayor parte, los hidrocarburos provienen del petróleo. Esto se debe a que el petróleo es el resultado de la descomposición de materia orgánica y por lo tanto ofrece gran cantidad y concentración de carbono e hidrógeno. Los derivados del petróleo, es decir, de los hidrocarburos, intervienen en múltiples industrias, desde la aeronáutica a la industria del juguete. 1.1.4 Tipos de orbitales que forman enlaces sigma y pi. - QOI-2014-I-Chocoteco Renteria Madai. A la vista de la forma en la que los enlaces se representan en las fórmulas químicas puede pensarse que los diferentes enlaces de una unión múltiple entre dos átomos de carbono son equivalentes.

Sin embargo, tanto la observación experimental como los resultados de la teoría del enlace químico indican que ello no es así; los dos enlaces de una unión doble no tienen la misma fuerza, uno se asemeja al de la unión simple carbono-carbono y recibe el nombre de enlace σ (sigma); el otro es más frágil y se denomina enlace π(pi). Esta situación puede explicarse de forma cualitativa recurriendo a la imagen de las nubes activas; a diferencia de lo que sucede en el etano, en el eteno pueden distinguirse para cada átomo de carbono dos tipos de nubes activas, una con tres lóbulos principales se encuentra en el plano de la molécula, la otra con dos se halla en un plano perpendicular. ENLACES PI ( π) & SIGMA (σ) Enlaces π En química, los enlaces pi (enlaces π) son enlaces químicoscovalentes donde dos lóbulos de un orbital involucrado en el enlace solapan con dos lóbulos del otro orbital involucrado.

Estos orbitales comparten un plano nodal que pasa a través de los núcleosinvolucrados. La letra griega π en su nombre se refiere a losorbitales p, dado que la simetría de los orbitales de los enlaces pi es la misma de la de los orbitales p. Generalmente, los orbitales p están involucrados en este tipo de enlace. Se asume que los orbitales d también participan en el enlace pi, pero esto no es necesariamente el caso en la realidad, aunque el concepto de enlace por medio de orbitales d explica bien la hipervalencia. Los enlaces pi son generalmente más débiles que los enlaces sigma, porque su densidad electrónica negativamente cargada está más lejos de la carga positiva del núcleo atómico, lo que requiere más energía.
Enlace σ El símbolo σ es la letra griega para s. Química Orgánica 6de6 Producción de enzimas. Química Orgánica 5de6 El Polietileno. Química Orgánica 4de6 fijando Combustibles. Química Orgánica 3de6 Enlaces del Carbono. Química Orgánica 2de6 La forma del Carbono. Química Orgánica 1de6 Introducción. Enlace Pi: Cómo Se Forma, Características y Ejemplos. ORGANICA. Alcanos. Los cuatro primeros tienen un nombre sistemático que consiste en los prefijos met-, et-, prop-, y but- seguidos del sufijo "-ano".

Los demás se nombran mediante los prefijos griegos que indican el número de átomos de carbono y la terminación "-ano". Otros nombres de la serie de los alcanos son los siguientes: Se llama radical alquilo a las agrupaciones de átomos procedentes de la eliminación de un átomo de H en un alcano, por lo que contiene un electrón de valencia disponible para formar un enlace covalente. Se nombran cambiando la terminación -ano por -ilo, o -il cuando forme parte de un hidrocarburo. Cuando aparecen ramificaciones (cadenas laterales) hay que seguir una serie de normas para su correcta nomenclatura. Se elige la cadena más larga. Se numeran los átomos de carbono de la cadena principal comenzando por el extremo que tenga más cerca alguna ramificación, buscando que la posible serie de números "localizadores" sea siempre la menor posible.
Seguridad y Salud Laboral: Compuestos Orgánicos Volátiles (COV), peligro respiratorio. (PL 72) SALUD AMBIENTAL.
SAAMB-COVs.doc. Manuel Domene. Palabras: 3.333 Los COV se evaporan fácilmente, contaminando la atmósfera, además de afectar a la salud de quienes los inhalan COV, Compuesto Orgánico Volátil, es cualquier sustancia orgánica que contiene carbón y que se evapora a temperatura ambiente. Algunos COV son muy tóxicos, como el benceno, el óxido de estireno, el percloroetileno o el tricloroetileno, que son cancerígenos, o el formaldehído y el estireno, que además son disruptores endocrinos. Los COV contaminan el aire y, cuando se mezclan con óxidos de nitrógeno, reaccionan generando ozono, cuya presencia en el aire respirable crea un efecto nocivo proporcional a la concentración.
¿Qué son los peligrosísimos Contaminantes Orgánicos Persistentes (COPs)? Los Contaminantes Orgánicos Persistentes (COPs) son sustancias químicas tóxicas, persistentes y bioacumulables en los organismos, causando efectos diversos en la salud humana y en el ambiente.
Son mezclas y compuestos químicos a base de carbono que incluyen compuestos industriales como los PCBs, plaguicidas como el DDT y residuos no deseados como las dioxinas. Los COPs son principalmente productos y subproductos de la actividad industrial, de origen relativamente reciente. Estas sustancias se transportan a grandes distancias a través del aire y el agua y se han dispersado por todo el mundo, hasta regiones muy distantes de su fuente original. La comunidad internacional tiene ahora que tomar acciones globales urgentes para eliminarlos.