

Feux d'artifices. La Propulsion ..........

Les Effets .......... La Lumière Retour au début de la page. Aspects chimiques : C'est probablement avec les premières armes à feux qu'est apparue la poudre noire ou poudre à canon; il fallait une matière susceptible de brûler rapidement et en même temps produire un volume important de gaz. A propos des couleurs dans les Feux d'artifices... Les couleurs Vous vous êtes sans doute déjà demandé comment étaient produites les différentes couleurs qui illuminent le ciel au cours des feux d'artifice...
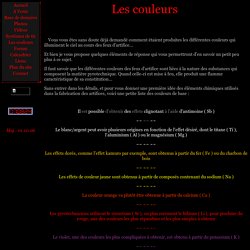
Et bien je vous propose quelques éléments de réponse qui vous permettront d'en savoir un petit peu plus à ce sujet. Feu d'artifice. Un article de Wikipédia, l'encyclopédie libre.
Feux d'artifice castillans lors d'une fête dans une banlieue sud de Mexico. Le feu d'artifice du 14 juillet à Paris Un feu d'artifice est un procédé pyrotechnique utilisant des explosifs déflagrants visant à produire du son, de la lumière et de la fumée. Les feux d'artifice sont souvent utilisés dans des spectacles pyrotechniques (fêtes nationales, jour de l'an, événements, etc.). Artifice vient du latin artificium qui signifie art.
.: Pyrotechnie :. A l'origine des phénomènes visibles et audibles qui composent un feu d'artifice sont des réactions de combustion similaires à certaine qui nous sont très familière : feu de bois, brûleur d'une cuisine à gaz.

La combustion Elle fait intervenir au moins deux corps qui réagissent et se recombinent en nouveaux corps avec libération de chaleur. C'est une réaction qui repose sur des échanges d'électrons entre les produits. Les couleurs des feux d'artifice dépendent des compositions métalliques ? C’est en profitant d’un moment agréable avec une amie proche de l’Opera House de Sydney, que comme dans les films hollywoodiens, nous entendions des feux d’artifice non loin.

Nous décidons d’aller y jeter un coup d’oeil. C’est alors que m’est venu l’idée d’écrire cet article. Savez-vous comment fait-on pour avoir une couleur différente pour chaque feu d’artifice ? Untitled. Explications physiques. Explications physiques sur les effets lumineux et sonores 1) Le phénomène physique qui libère de la lumière Nous avons déjà parlé du postulat des quantifications d’énergie de l’atome que Bohr (1883-1962) déposa en 1913,qui explique que les électrons s’organisent en couches concentriques qui partent du noyau et s’en éloignent, mais aussi comment la matière fait pour émettre de la lumière.

On parle d’incandescence pour désigner la lumière, le rayonnement de tout corps qui est chauffé. Fait intéressant, l’intensité de la lumière émise, est proportionnelle à la puissance quatrième de la température (si on multiple par 4 la température, on multiplie l’intensité par 256). On retrouve ce phénomène d’incandescence avec le magnésium par exemple. Histoire et Technique des Feux d'Artifice.
Histoire des feux d'artifice : Les débuts : Vers l'an 675, les soldats grecs utilisèrent le feu grégeois au cours du siège de Constantinople.

Les sarrasins furent épouvantés par les effets étranges de ce feu artificiel. Ces feux étaient fabriqué avec de la résine inflammable de pin, de naphte et du soufre. VIII ème ou IX ème siècle : Ce sont peut-être les chinois découvrent la poudre noire, mélange de salpêtre, charbon de bois et soufre. Les feux d'artifice, comment ça marche ? Chaque fusée de feu d'artifice demande un mélange subtil de produits chimiques entre l'oxydant, le carburant et le colorant.
Découvrez dans cette vidéo les rouages de la pyrotechnique en laboratoire. A l’approche des fêtes nationales américaines et françaises, chacun s’apprête à aller se gaver les yeux à un feu d’artifice. Mais qu’est ce qui se cache derrière la science de la pyrotechnie ? Avant tout, c’est de la chimie. Petite histoire des feux d’artifice. Des feux qui nous viennent de Chine La Chine connaît la poudre et l’art d’en faire des explosions de bruit ou de lumière au moins depuis le VIIIème-IXème siècle.
L’empereur de Chine affirme même en 1719 que son pays maîtrise les feux d’artifice depuis plus de 2000 ans. La poudre noire : une invention chinoise. La poudre noire : une invention chinoise Nous devons l’invention de la poudre noire ou poudre à canon à la civilisation chinoise, qui est l’une des plus anciennes du monde.
Les Chinois ont été les premiers à lancer des feux d'artifice à l'occasion des fêtes et à mettre au point différentes armes à feu. Voici l’histoire de cette invention.Temps de lecture moyen : 2'03 Partager Une invention majeure. Feu d'artifice-Fonctionnement. Mèche fusante : mèche se consumant rapidement (environ 10 mètres/seconde) Charge propulsive ou «chasse» : charge explosive faite de poudre noire, permettant à l’effet pyrotechnique de s’élever dans l’air Mèche-retard (espolette) : mèche permettant de retarder l’ouverture de la pièce pyrotechnique pendant la montée (durée : de 1 à 5 secondes) Coquille : contenant rigide dans lequel on retrouve les effets pyrotechniques, la charge d’ouverture ainsi que la mèche-retardÉtoile : petite sphère ou cylindre composée de poudre noire et d’un ou de plusieurs sels métalliques qui lorsqu’elle brûle émet une couleur prédéterminée selon la sorte de sel métallique ajoutée dans la composition (ex : sel de cuivre = bleu, sel de strontium = rouge)Charge d’éclatement : charge explosive permettant l’allumage et la dispersion des étoiles dans le ciel.
L.A Polytechnie - Artistes et Artificiers - Basse Normandie - Manche. Il existe deux types de feux d'artifices : Les Compacts et les Bombes. Parmis les différents feux, certains sont diponibles en plusieurs couleurs; par exemples l'Eventaillos (photos ci dessous) est disponible en rouge, vert, violet, orange et argent. Ci dessous quelques explications concernant les deux types de feux. Les Compacts Effets pyrotechniques, comètes, volcans ou bombettes, logés dans des tubes cartons assemblés entre eux. A quand des feux d'artifice verts. Les feux d’artifice ce n’est pas toujours joli, joli. Il y a trois ans, Terra eco rappelait que Paris utilise 3 tonnes de bombes pour son 14 juillet. Mais un feu d’artifice c’est quoi ? Une poudre noire (charbon, soufre et salpêtre) contenant un composé oxydant (souvent du perchlorate de potassium) qui libère de l’oxygène.
Un composé réducteur joue, lui, les combustibles et produit la couleur grâce à des métaux : sodium pour le jaune, strontium pour le rouge, baryum pour le vert... Feu d'artifice : quelle réaction chimique est mise en jeu ? Feux d'artifice : comment obtient-on des couleurs ? Les couleurs des feux d’artifice sont obtenues par adjonction de métaux ou de sels métalliques. Voici les éléments utilisés pour différentes couleurs : Blanc : magnésium ou aluminium ;Rouge : sels de strontium ou de lithium ;Orange : sels de calcium ;Jaune : sels de sodium ; Vert : sels de baryum ou de cuivre ;Bleu : sels de cuivre ;Violet : sels de potassium. Feu d'artifice multicolore - © Creative Commons : Ahisgett À voir aussi sur Internet Sur le même sujet.