

Lyophilisation. Un article de Wikipédia, l'encyclopédie libre.
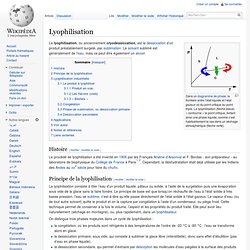
Dans un diagramme de phase, la frontière entre l’état liquide et l’état gazeux va du point critique au point triple. La lyophilisation (flèche bleue) « contourne » le point critique, évitant ainsi une phase liquide, comme c’est habituellement le cas dans un séchage atmosphérique (flèche verte). Histoire[modifier | modifier le code] Le procédé de lyophilisation a été inventé en 1906 par les Français Arsène d’Arsonval et F. Bordas - son préparateur - au laboratoire de biophysique du Collège de France à Paris[1],[2]. Principe de la lyophilisation[modifier | modifier le code] On distingue trois phases majeures dans un cycle de lyophilisation : À la fin du cycle, le produit ne contient plus que 1 % à 5 % d’eau, ce qui est extrêmement faible. Lac acide. Acide sulfurique. Un article de Wikipédia, l'encyclopédie libre.
Effet de l'acide sulfurique sur une serviette en coton. Cloques emplies de lymphe résultant d'une brûlure causée par exposition de la peau à de l'acide sulfurique (archives médicales militaires de l'US Army, seconde guerre mondiale) L’acide sulfurique, appelé jadis huile de vitriol ou vitriol, est un composé chimique de formule H2SO4. C'est un acide minéral dont la force (pKa = -3,0) est seulement dépassée par quelques superacides. Il est miscible à l'eau en toutes proportions, où il se dissocie en libérant des cations hydronium : 2 H3O+(aq) + SO42-(aq).
Propriétés et réactions[modifier | modifier le code] Propriétés physiques[modifier | modifier le code] Acide concentré et acide dilué[modifier | modifier le code] L'acide sulfurique pur est un liquide visqueux, incolore et inodore. Presque tout l'acide sulfurique s'est décomposé en eau et trioxyde de soufre à 450 °C. Potentiel hydrogène. Un article de Wikipédia, l'encyclopédie libre.
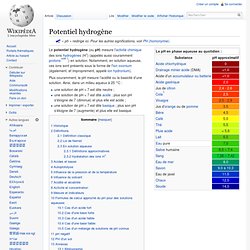
Le potentiel hydrogène (ou pH) mesure l'activité chimique des ions hydrogènes (H+) (appelés aussi couramment protons[note 1]) en solution. Notamment, en solution aqueuse, ces ions sont présents sous la forme de l'ion oxonium (également, et improprement, appelé ion hydronium). Plus couramment, le pH mesure l’acidité ou la basicité d’une solution. Ainsi, dans un milieu aqueux à 25 °C : Historique[modifier | modifier le code] Le principe d’une telle échelle de pH est accepté par la communauté scientifique, notamment grâce au chimiste allemand Leonor Michaelis qui publie en 1909 un livre sur la concentration en ion hydronium (H3O+)[5]. Par la suite, la lettre p est reprise dans plusieurs notations usuelles en chimie, pour désigner le cologarithme : pK, pOH, pCl… La signification du sigle pH a été adaptée par chaque langue.
Xénon. Un article de Wikipédia, l'encyclopédie libre.
Pour les articles homonymes, voir Xenon et XE. Le xénon est un élément chimique, de symbole Xe et de numéro atomique 54. Le xénon est un gaz noble, inodore et incolore. Dans une lampe à décharge, il émet une lumière bleue. Le xénon est le plus rare et le plus cher des gaz nobles, à l'exception du radon dont tous les isotopes sont radioactifs. Étymologiquement, le nom de « xénon » dérive du mot grec ξένος (xenos), se traduisant par « étranger ». Le xénon a été découvert en 1898 par William Ramsay et par Morris William Travers par analyse spectrale de « résidus » de l'air dont on avait éliminé l'oxygène et l'azote. On extrait le xénon par distillation de l'air.
Histoire[modifier | modifier le code] Le xénon a été découvert par les chimistes britanniques William Ramsay et Morris Travers le 12 juillet 1898, peu après leur découverte du krypton et du néon. En 1939, Albert R. Ozone. Un article de Wikipédia, l'encyclopédie libre.
Pour l’article homophone, voir O-Zone. L'ozone (de l'allemand ozon dérivé du grec ozô « exhaler une odeur »), ou trioxygène, est une molécule triatomique formée de trois atomes d'oxygène et donc de formule chimique O3. C'est une variété allotropique de l'oxygène bien moins stable que le dioxygène O2, en lequel il tend naturellement à se décomposer. Tableau périodique des éléments. Un article de Wikipédia, l'encyclopédie libre.
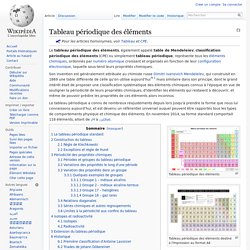
Le tableau périodique des éléments, également appelé table de Mendeleïev, classification périodique des éléments (CPE) ou simplement tableau périodique, représente tous les éléments chimiques, ordonnés par numéro atomique croissant et organisés en fonction de leur configuration électronique, laquelle sous-tend leurs propriétés chimiques.
Son invention est généralement attribuée au chimiste russe Dimitri Ivanovich Mendeleïev, qui construisit en 1869 une table différente de celle qu'on utilise aujourd'hui[N 1] mais similaire dans son principe, dont le grand intérêt était de proposer une classification systématique des éléments chimiques connus à l'époque en vue de souligner la périodicité de leurs propriétés chimiques, d'identifier les éléments qui restaient à découvrir, et même de pouvoir prédire les propriétés de ces éléments alors inconnus. Tableau périodique des éléments Tableau périodique des éléments destiné à l'impression au format A4.