

1958 création association AFM-Téléthon. 1987 1er Téléthon. 1986 : la naissance du Téléthon C’est à l’initiative de deux pères dont les fils sont atteints de myopathie, Bernard Barataud (Président de l'AFM) et Pierre Birambeau (directeur du développement) que le Téléthon voit le jour.
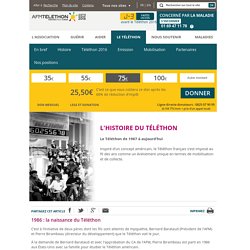
À la demande de Bernard Barataud et avec l'approbation du CA de l'AFM, Pierre Birambeau est parti en 1986 aux États-Unis avec sa famille pour étudier le Téléthon américain. Bernard et Pierre en ont déduit les propositions permettant d'adapter en France le marathon télévisuel organisé depuis 1966 par le comédien Jerry Lewis.Sur la base du dossier qu'ils ont fait, ils parviennent à convaincre les dirigeants d’Antenne 2 (aujourd’hui France 2) d’adapter l’émission à la télévision française. 1987 : le premier Téléthon Le premier Téléthon est lancé le vendredi 4 décembre à 20h30 sur Antenne 2 en direct des studios de Radio France.
Lire : Les parrains du Téléthon depuis 1987 L’émission obtient un succès retentissant. 1987 – 2014 : la fidélité des Français. 1990 création laboratoire Généthon. 1984 CEPH Centre d'Étude Polymorphisme Humain. 2005 création I-Stem. I-STEM Institut de recherche & formation. 1964 création INSERM institut public.
Histoire Institut de recherche INSERM. 1991 Université Evry Val d'Essonne. 1998 Genopole Evry. 2012 visite de François Hollande à Genopole. Laurence Tiennot-Herment, Thierry Mandon, François Hollande, Pierre Tambourin et Manuel Walls A l’issue d’une présentation du bioparc et des enjeux économiques, industriels et éthiques des biotechnologies, par Thierry Mandon et Pierre Tambourin , respectivement président et directeur général de Genopole®, et Laurence Tiennot-Herment , présidente de l’AFM, François Hollande constate ce que peuvent apporter en termes de soin et de santé « la recherche à un niveau élevé et les entreprises » du bioparc : « il faut faire le choix d’un grand défi technologique qui doit être mené avec l’appui de tous. » « Poursuivre le débat éthique » Manuel Walls, François Hollande, Jean-Paul Huchon et Jérome Guedj.
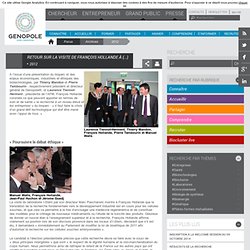
Dossier de presse HOLLANDE Genopole-2012. Extrait compte-rendu visite Hollande 2012. Sauvegarde article la visite de F.Hollande. 1999 bases de données Biotechnologies France. Edmond Rothschild Investment Partners. Investir bioDiscovery bpiFrance Rothschild. Le Denosumab. Le denosumab (Prolia®) appartient à une nouvelle catégorie de médicaments pour traiter l’ostéoporose appelée inhibiteur du ligand du Rank.
Le denosumab est un traitement anti-ostéoclastique qui empêche le développement et l’activation des ostéoclastes (cellules qui érodent le tissu osseux). Même s’il agit de façon unique par rapport aux autres agents anti-ostéoporotique, le denosumab fait partie de la catégorie de médicaments anti-résorption. Le denosumab réduit le risque de fracture de la colonne, de la hanche et d’autres sites de fractures chez les femmes atteintes d’ostéoporose postménopausique. Le denosumab peut être utilisé pour réduire le risque de fracture chez les femmes ménopausées atteintes d’ostéoporose. Le denosumab est administré par injection sous-cutanée de 60 mg, tous les six mois, par un professionnel de la santé qualifié. Les effets secondaires liés au denosumab sont similaires à ceux du placebo. En savoir plus à propos des traitements pharmacologiques : XGEVA 120 mg (denosumab) Monographie 2012 AMGEN Canada.
XGEVA 120 mg. Dénosumab 60 mg (Prolia®) & dénosumab 120 mg (Xgeva®) Le dénosumab est un anticorps monoclonal (IgG2) humain qui cible le RANKL, ligand du récepteur RANK.
Il se lie de façon spécifique au RANKL avec une forte affinité, empêchant l’activation du récepteur RANK situé à la surface des ostéoclastes et de leurs précurseurs. Le blocage de l’interaction RANK/RANKL inhibe la formation, la fonction et la survie des ostéoclastes et diminue ainsi la résorption osseuse dans l’os cortical et trabéculaire. L’ostéonécrose de la mâchoire (ONM) est une condition dans laquelle l’os de la mâchoire devient nécrotique, mis à nu et ne cicatrise pas dans un délai de 8 semaines.
L’étiologie de l’ONM n’est pas clairement définie, mais elle pourrait être associée à l’inhibition du remodelage osseux. Les facteurs de risques connus d’ONM incluent les interventions dentaires invasives (par exemple extraction dentaire, implant dentaire, chirurgie buccale), une mauvaise hygiène buccale ou une autre affection dentaire pré-existante.